
称取上述混合物20.0 g与2 mol·L-1盐酸160.0 mL充分反应。
(1)若混合物中,n(CaCO3)=n(KHCO3),则可生成的气体的体积(标准状况)为____________L。
(2)若混合物中,n(CaCO3)≠n(KHCO3),则所生成的气体的物质的量可能是____________(填序号)。
A.0.22 mol B.0.20 mol C.0.18 mol D.0.16 mol
结合简单计算和推理,简要说明不作出相关选项选择的理由分别是_____________________;_____________________。
(1)4.48 (2)BC
M(CaCO3)=M(KHCO3)=100 g·mol-1,20.0 g混合物的物质的量为0.20 mol。最多生成n(CO2)=0.20 mol,故不选A 20.0 g试样若全为CaCO3,则生成CO2的量最少,应以n(HCl)计算,为0.16 mol,故不选D
解析:M(CaCO3)=M(KHCO3)=100 g·mol-1,则20.0 g混合物为0.2 mol。
n(HCl)=2 mol·L-1×0.16 L=0.32 mol
由反应CaCO3+2HCl====CaCl2+H2O+CO2↑和KHCO3+HCl====KCl+H2O+CO2↑,可知若样品全部为CaCO3时,HCl不足量,而全部为KHCO3时,HCl有剩余,当n(CaCO3)=n(KHCO3)=0.1 mol时,HCl剩余0.02 mol,混合物完全反应,应生成n(CO2)=0.2 mol,即4.48 L。当n(CaCO3)≠n(KHCO3)时,如上所述,若全部为CaCO3,应根据n(HCl)计算CO2,n(CO2)=0.16 mol,故不能选。由于n(混合物)=0.2 mol,故最多可生成CO2 0.2 mol,A不能选。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 现象:溶液显紫色;另取该溶液滴入Na2CO3溶液中,无明显现象.
现象:溶液显紫色;另取该溶液滴入Na2CO3溶液中,无明显现象. 现象:溶液显蓝色;另取该溶液滴入Na2CO3溶液中的现象为
现象:溶液显蓝色;另取该溶液滴入Na2CO3溶液中的现象为 现象:有气泡产生,有关反应的离子方程式为
现象:有气泡产生,有关反应的离子方程式为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
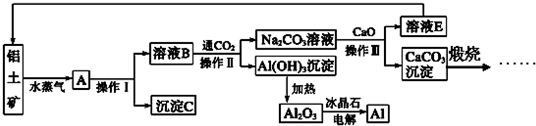
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
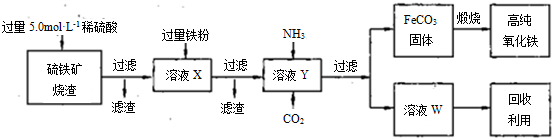
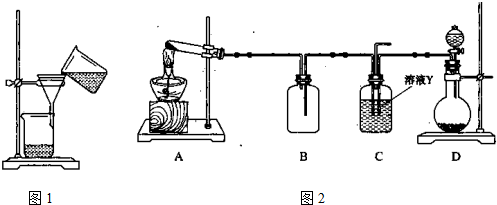
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com