
| A. | 青蒿素是一种氧化物 | |
| B. | 青蒿素的摩尔质量为 282 | |
| C. | 56.4g青蒿素中所含氧原子数目为 6.02×1023个 | |
| D. | 青蒿素中 C、H、O元素的质量比为 15:22:5 |
分析 A、氧化物是只含有两种元素且其中一种元素是氧元素的化合物;
B、摩尔质量是有单位的,单位为g/mol;
C、56.4g青蒿素的物质的量为:$\frac{56.4g}{282g/mol}$=0.2mol,所以氧原子的物质的量为0.2×5=1mol;
D、根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析判断.
解答 解:A、青蒿素是由碳、氢、氧三种元素组成的化合物,不属于氧化物,故A错误;
B、摩尔质量是有单位的,单位为g/mol,所以青蒿素的摩尔质量为 282g/mol,故B错误;
C、56.4g青蒿素的物质的量为:$\frac{56.4g}{282g/mol}$=0.2mol,所以氧原子的物质的量为0.2×5=1mol,所以含氧原子数目为 6.02×1023个,故C正确;
D、青蒿素中碳、氢、氧三种元素的质量比为(12×15):(1×22):(16×5)=90:11:40,故D错误;
故选C.
点评 本题难度不大,考查同学们结合新信息、灵活运用化学式的含义与有关计算等进行分析问题、解决问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 稀盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 钠与硝酸铜溶液反应:2Na+Cu2+=Cu+2Na+ | |
| C. | KHCO3溶液与稀H2SO4反应:CO32-+2H+=H2O+CO2↑ | |
| D. | 醋酸钠水解:CH3COO-+H2O?CH3COOH+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰融化,克服的是H2O的分子间作用力 | |
| B. | 同分异构现象存在,是有机化合物种类繁多的原因之一 | |
| C. | 在N2、CO2和SiO2物质中,都存在共价键,它们都是由分子构成 | |
| D. | Na2 O2属于离子化合物,该物质中存在离子键和共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
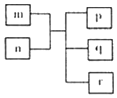 短周期主族元素X、Y、Z、W原子序数依次递增,Y原子最外层电子数为次外层电子数的二倍.m为元素Y的单质,n为元素Z的最高价氧化物的水化物,p、q、r分别为上述四种元素组成的二元化合物.下列说法正确的是( )
短周期主族元素X、Y、Z、W原子序数依次递增,Y原子最外层电子数为次外层电子数的二倍.m为元素Y的单质,n为元素Z的最高价氧化物的水化物,p、q、r分别为上述四种元素组成的二元化合物.下列说法正确的是( )| A. | 原子半径Y<Z<W | |
| B. | 简单气态氢化物的稳定性Y>Z>W | |
| C. | 简单气态氢化物沸点Y>Z | |
| D. | X、Z、W三种元素可以形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
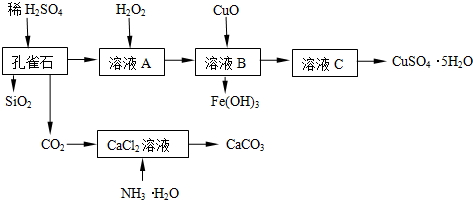
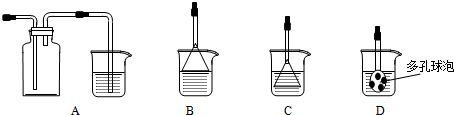
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
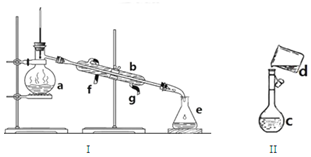 掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com