
| A. | 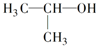 的名称:2-甲基乙醇 的名称:2-甲基乙醇 | B. | 聚丙烯的链节: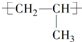 | ||
| C. | 甲酸甲酯的结构简式:C2H4O2 | D. | 比例模型为 的分子可发生加成反应 的分子可发生加成反应 |
分析 A.含-OH的主链含3个C;
B.聚丙烯的链节为重复出现的结构单元,不含中括号;
C.结构简式中体现官能团;
D.比例模型为 ,为乙烯,含碳碳双键.
,为乙烯,含碳碳双键.
解答 解:A.含-OH的主链含3个C,可知名称为2-丙醇,故A错误;
B.聚丙烯的链节为重复出现的结构单元,不含中括号,链节为-CH2-CH(CH3)-,故B错误;
C.甲酸甲酯的分子式为C2H4O2,结构简式中体现官能团,结构简式为HCOOCH3,故C错误;
D.比例模型为 ,为乙烯,含碳碳双键,可发生加成反应,故D正确;
,为乙烯,含碳碳双键,可发生加成反应,故D正确;
故选D.
点评 本题考查常见化学用语的表示方法,为高频考点,把握结构简式、比例模型及有机物的结构与性质为解答的关键,侧重分析与应用能力的考查,注意化学用语的规范使用,题目难度不大.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
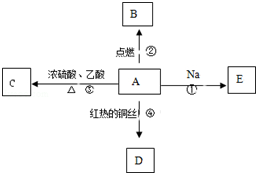 A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应.
A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
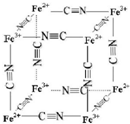 铁及其化合物在生产生活及科学研究方面应用非常广泛.
铁及其化合物在生产生活及科学研究方面应用非常广泛. ,其空间构型为直线型;
,其空间构型为直线型;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2、I2、Hg | B. | CO2、KCl、SiO2 | C. | Na、K、Rb | D. | SiC、NaCl、SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应的特征是元素化合价发生了改变 | |
| B. | 含化合价升高元素的反应物被还原 | |
| C. | 得到电子的物质被氧化 | |
| D. | 氧化还原反应中,氧化剂和还原剂一定是两种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
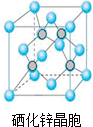 硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物.
硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 加入盐酸积V/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
| 测得溶液温度/℃ | 15.2 | 19.6 | 22.0 | 26.0 | 28.2 | 26.7 | 25.7 | 24.7 | 23.7 | 22.9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com