
分析 (1)根据溶液的pH计算溶液中氢离子浓度,根据氢氧化钠的浓度计算氢氧根离子浓度,再结合Kw=c(H+).c(OH-)计算即可;
(2)①将pH=a的NaOH溶液Va L与pH=b的硫酸Vb L混合,若所得混合溶液为中性,且a=12,b=2,根据c(OH-)×Va=c(H+)×Vb计算;
②所得混合溶液为中性,a+b=12,Va:Vb=$\frac{1{0}^{-b}}{1{0}^{a-13}}$=1013-a-b.
解答 解:(1)0.01mol•L-1的NaOH溶液的pH为11,则氢离子浓度=10-11 mol/L,氢氧化钠是强电解质完全电离,所以溶液中氢氧根离子浓度是0.01mol/L,则Kw=c(H+).c(OH-)=0.01×10-11=10-13,
故答案为:10-13;
(2)①若所得混合溶液为中性,且a=12,b=2,因c(OH-)×Va=c(H+)×Vb,a=12,b=2,则0.1×Va=0.01Vb,则Va:Vb=1:10
故答案为:1:10;
②若所得混合液为中性,且a+b=12,Va:Vb=$\frac{1{0}^{-b}}{1{0}^{a-13}}$=1013-a-b=10,则Va:Vb=10:1,
故答案为:10:1;
点评 本题考查了水的离子积常数的计算、酸碱混合的计算,注意水的离子积常数只与温度有关,与溶液是酸碱性无关,为易错点.明确该温度下的Kw及pH与浓度的换算是解答本题的关键,注意酸碱反应的实质,题目难度中等.


科目:高中化学 来源: 题型:选择题

| A. | (3)(4)(2)(1) | B. | (3)(1)(4)(2) | C. | (4)(3)(1)(2) | D. | (3)(4)(1)(2) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
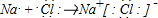 .
. .
. ②NaOH
②NaOH ③NH3
③NH3 ④N2
④N2
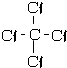 ③NH3
③NH3 ④H2SH-S-H.
④H2SH-S-H.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期元素中A的金属性最强 | |
| B. | 原子半径A>B,离子半径A+>C2- | |
| C. | 同族元素中C的氢化物稳定性最高 | |
| D. | 同周期元素中B的最高价含氧酸的酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S溶液使酚酞试液变红:S2-+2H2O?2OH-+H2S | |
| B. | 用右图装置电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ | |
| C. | NaHCO3溶液使酚酞试液变红:HCO3-+H2O?H3O++CO32- | |
| D. | 用AlCl3溶液使石蕊试液变红:Al3++3H2O?Al(OH)3+3 H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

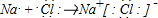
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF、HCl、HBr、HI的热稳定性依次减弱 | |
| B. | 水加热到很高的温度都难以分解 | |
| C. | CH4、SiH4、GeH4、SnH4的熔点随相对分子质量的增大而升高 | |
| D. | 氨气在水中溶解度很大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )| 选项 | ①中的物质 | ②中的物质 | 预测的现象 |
| A | 淀粉KI溶液 | 浓硝酸 | ①中溶液变蓝 |
| B | 浓盐酸 | 浓氨水 | 大烧杯上部出现白烟 |
| C | 酚酞试液 | 浓盐酸 | ①中溶液变红 |
| D | 湿润红纸条 | 饱和氯水 | 红纸条褪色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有如下两个反应:
现有如下两个反应:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com