
【题目】常温下,向20.00mL0.1000molL-1的氨水中逐滴加入0.1000molL-1的盐酸,pH随盐酸体积的变化如图所示(不考虑NH3的逸出)。下列说法不正确的是( )

A. 反应过程中:c(NH4+)+c(H+)=c(OH-)+c(Cl-)
B. V(HCl)=10.00mL时,c(NH4+)>c(Cl-)>c(NH3H2O)
C. V(HCl)<20.00mL时,溶液一定呈碱性
D. V(HCl)=30.00mL时,2c(Cl-)=3c(NH4+)+3c(NH3H2O)
【答案】C
【解析】A.反应过程中一定满足电荷守恒:c(NH4+)+c(H+)=c(OH-)+c(Cl-),A正确;B.V(HCl)=10.00mL时,氨水过量,反应后溶质为等浓度的氯化铵和一水合氨,一水合氨的电离程度大于铵根离子的水解程度,则c(NH4+)>c(NH3H2O),根据物料守恒c(NH4+)+c(NH3H2O)=2c(Cl-)可知:c(NH4+)>c(Cl-)>c(NH3H2O),B正确;C.V(HCl)=20.00mL时,反应后溶质为氯化铵,溶液呈酸性,则V(HCl)<20.00mL时溶液可能为中性,C错误;D.V(HCl)=30.00mL时,加入HCl的总物质的量为:0.1000mol/L×0.03L=0.003mol,原溶液中一水合氨的总物质的量:0.1000mol/L×0.02L=0.002mol,根据物料守恒可得:2c(Cl-)=3c(NH4+)+3c(NH3H2O),D正确,答案选C。


科目:高中化学 来源: 题型:
【题目】向含有Fe2+、I-、Br-的溶液中缓慢通入氯气,溶液中各种离子的物质的量变化如图所示。下列说法正确的是

A. 当通入2 mol Cl2时,溶液中发生的离子反应是:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
B. DE段表示n(Fe2+)的变化情况
C. 原溶液中n(Fe2+)∶n(I-)∶n(Br-)=3∶1∶2
D. B点时溶液中含有I-和Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336ml(标准状况)气体。回答下列问题:

(1)根据图中c、d两极上产生气体的体积判断电源N极为_______极(填“正”或“负),电解池中a为______极。请写出a极的电极反应式:___________________.
(2) AgNO3溶液的浓度________(填“增大”“减小”或“不变”,下同),AgNO3溶液的pH_________,H2SO4溶液的浓度__________,H2SO4溶液的pH________.
(3)上述过程中通过电路的电子______mol.
(4)若H2SO4溶液中溶质的质量分数由5.00%变为5.02%,则原有的5.00%溶液为____g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学平衡常数的说法中,正确的是
A.可以用化学平衡常数来定量描述化学反应的限度
B.在平衡常数表达式中,反应物浓度用起始浓度表示,生产物浓度用平衡浓度表示
C.平衡常数的大小与浓度、压强、催化剂有关
D.化学平衡发生移动,平衡常数必定发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组按下列路线合成饮料、香水的增香剂香豆素。
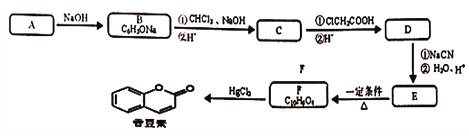
已知:
1. 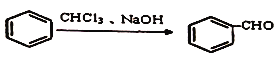
2. 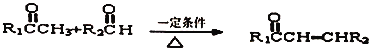
3. 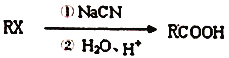
请回答:
(1) C→D的反应类型是________。
(2)下列说法不正确的是________。
A.化合物A的官能团是羧基 B.化合物B的水溶液显碱性
C.化合物D能发生银镜反应 D.香豆素的分子式是C9H8O2
(3)写出E→F的化学反应方程式________。
(4)设计以苯、乙烯为主要原料制备![]() 的合成路线(用流程图表示,无机试剂任选)____。
的合成路线(用流程图表示,无机试剂任选)____。
(5)G为C的同分异构体,并符合下列条件。写出G的结构简式____。
①分子除含有苯环外不含其它环状结构;②lmolG最多能与2molNaOH反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuCl2·2H2O制备CuCl,并进行相关探究。
【资料查阅】

【实验探究】该小组用下图所示装置进行实验(夹持仪器略)。

请回答下列问题:
(1)D装置的作用_________________。
(2)装置D中发生的氧化还原反应的离子方程式是________________。
(3)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是____________。
(4)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuO杂质,根据资料信息分析:则产生的原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池用于航天飞船,电极反应产生的水,经冷凝后可作为航天员的饮用水,其电极反应如下:①2H2+4OH﹣﹣4e﹣=4H2O,②O2+2H2O+4e﹣=4OH﹣ 当得到1.8L饮用水时,电池内转移的电子数约为( )
A.1.8mol
B.3.6mol
C.100mol
D.200mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com