
分析 (1)溶液中的离子积Kw=C(H+)×c(OH-)=10-a×10-b=10-(a+b)=10-12;
(2)根据硫酸中氢离子与氢氧化钠中氢氧根离子的物质的量判断过量,然后计算出反应后溶液中氢离子浓度,最后计算出其余的pH;
(3)根据溶液中的电荷守恒来分析.
解答 解:(1)溶液中的离子积Kw=C(H+)×c(OH-)=10-a×10-b=10-(a+b)=10-12,故答案为:10-12;
(2)100mL 0.1mol•L-1的稀H2SO4溶液中氢离子的物质的量为:0.1mol/L×2×0.1L=0.02mol,
100mL 0.4mol•L-1的NaOH溶液中氢氧根离子的物质的量为:0.4mol/L×0.1mol=0.04mol,
两溶液混合后氢氧根离子过量,反应后氢氧根离子的浓度为:$\frac{0.04mol-0.02mol}{0.2L}$=0.1mol/L,
根据水的离子积常数Kw=10-12可得,溶液中氢离子浓度为:$\frac{1{0}^{-12}}{0.1}$=10-11mol/L,该溶液的pH=11.
此溶液中的氢离子全部是由水电离出的,故水电离出的C(H+)=1×10-11mol/L,而水电离出的C(OH-)=C(H+),故水电离出的C(OH-)=1×10-11mol/L.
故答案为:11;1×10-11mol/L;
(3)CH3COOH和CH3COONa的混合溶液,若测得混合液的PH=6,即C(H+)=10-6mol/L,由于水的离子积为10-12,故C(OH-)=10-6mol/L.
根据电荷守恒可知:C(CH3COO-)+C(OH-)=C(Na+)+C(H+),故C(CH3COO-)-C(Na+)=C(H+)-C(OH-)=0,故答案为:0.
点评 本题考查了溶液pH的有关计算以及盐溶液中的电荷守恒的运用,难度不大,注意在计算时水的离子积的数值的变化.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO42- | B. | NO3- | C. | SCN- | D. | CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①③ | C. | ②④⑥ | D. | ②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝片跟氢氧化钠溶液反应:Al+2OH-═AlO2-+H2↑ | |
| B. | 硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ | |
| C. | 硫酸氢钠与氢氧化钠溶液反应:H++OH-═H2O | |
| D. | 铜片跟稀硝酸反应:Cu+NO3-+4H+═Cu2++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
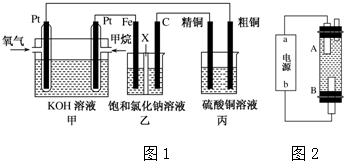
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO3>HI>Fe2+>NO | B. | HI>Fe2+>H2SO3>NO | ||
| C. | Fe2+>HI>H2SO3>NO | D. | NO>Fe2+>H2SO3>HI |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实 验 操 作 | 现 象 | 实 验 结 论 | |
| A | 向某溶液中加入硝酸酸化的氯化钡溶液 | 生成白色沉淀 | 溶液中一定含有SO42- |
| B | 将某溶液蘸取少量放置于火焰上灼烧 | 火焰呈黄色 | 该溶液中一定含K+ |
| C | 往某溶液中加入KSCN溶液 | 显血红色 | 溶液中一定含有Fe3+ |
| D | 往某溶液中加入盐酸 | 产生无色气体 | 溶液中一定含有CO32- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
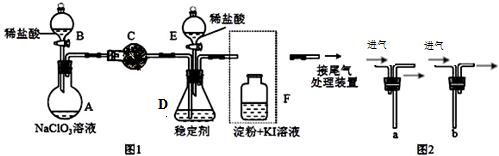

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com