
| A. | 某吸热反应能自发进行,因此该反应是熵增反应 | |
| B. | 2NO(g)+2CO(g)═N2(g)+2CO2(g)在常温下能自发进行,则该反应的△H>0 | |
| C. | 反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H<0 | |
| D. | CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H>0 |
分析 A.根据△H-T•△S<0反应自发分析;
B.该反应△S<0,要使△H-T•△S<0反应自发,必有△H<0;
C.该反应△S<0,在室温下△H-T•△S<0反应自发;
D.该反应△S>0,△H-T•△S>0不能自发进行,必有△H>0.
解答 解:A.△H-T•△S<0反应自发,吸热反应△H>0,只有△S>0才能使△H-T•△S<0,故A正确;
B.该反应气体体积减小,△S<0,要使△H-T•△S<0反应自发,必有△H<0,故B错误;
C.该反应△S<0,在室温下△H-T•△S<0反应自发,必有△H<0,故C正确;
D.该反应有气体生成,△S>0,△H-T•△S>0不能自发进行,必有△H>0,故D正确;
故选B.
点评 本题考查了化学反应进行的方向,难度不大,注意根据△G=△H-T•△S<0反应自发分析各选项.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
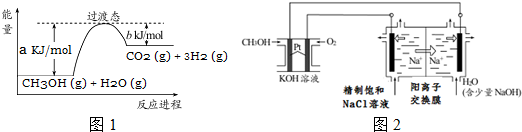
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅是酸性氧化物,它不溶于任何酸 | |
| B. | 高纯度的硅单质广泛用于制作光导纤维 | |
| C. | 二氧化碳通入水玻璃可以制得硅酸 | |
| D. | 水泥、玻璃、水晶饰物都是硅酸盐制品 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
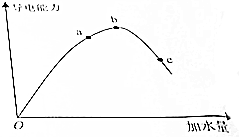 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示,请回答:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示,请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com