

| 甲 | 乙 | |
| 所选试剂X | H2O2 | H2O2,少量稀H2SO4 |
| 操作 | 向5mLM和淀粉的混合溶液中加入1mL H2O2 | 向5mLM和淀粉的混合溶液中加入1mL H2O2,再加少量稀H2SO4 |
| 实验现象 | 几秒钟后,溶液呈现很淡的蓝色 | 溶液立刻呈现较深的蓝色 |
分析 (1)操作①是将固体与溶液分离,该操作方法为过滤;操作③为将碘单质与四氯化碳分离,需要通过蒸馏操作完成;操作②是将碘单质从溶液中分离出来,需要通过分液操作完成,据此判断使用的主要玻璃仪器;
(2)碘单质在碱性条件下被氯气氧化成碘酸钾,据此写出反应的离子方程式;
(3)①溶液M中含有碘离子,酸性条件下碘离子被双氧水氧化成碘单质,据此写出反应的离子方程式;
②根据表中甲和乙的选用试剂及实验现象进行分析;
(4)①KI变质除了与O2和H2O有关外,还应与空气中的某种气体成分Y有关,则Y应为CO2,酸性条件下碘离子被氧化;
②KI固体在空气中变质,与氧气、水、二氧化碳反应生成碳酸氢钾、碘.
解答 解:(1)根据图1可知,操作①是将海带灰悬浊液中不溶物与溶液分离,其操作方法为过滤;操作③是将碘单质与四氯化碳分离,由于碘单质易溶于四氯化碳溶液,所以需要通过蒸馏操作完成;
操作②的目的是将碘单质从混合液中分离出来,可通过分液存在完成,使用的主要仪器为分液漏斗,
故答案为:过滤;蒸馏;烧杯、分液漏斗;
(2)根据制备流程可知,碘单质与氯气、氢氧根离子反应生成碘酸钾、氯离子和水,反应的离子方程式为:I2+5Cl2+12OH-=2IO3-+10Cl-+6H2O,
故答案为:I2+5Cl2+12OH-=2IO3-+10Cl-+6H2O;
(3)①乙同学选用试剂X为双氧水,溶液M中含有碘离子,碘离子被双氧水氧化成碘单质,反应的离子方程式为:2I-+H2O2+2H+=I2+2H2O,
故答案为:2I-+H2O2+2H+=I2+2H2O;
②根据表中信息可知,在酸性条件下,双氧水更容易氧化碘离子,所以得出的结论为:溶液的酸碱性会影响H2O2的氧化能力,
故答案为:溶液的酸碱性会影响H2O2的氧化能力;
(4)①酸性条件下,碘离子可被氧化,则KI变质除了与O2和H2O有关外,还应与空气中的某种气体成分Y有关,则Y应为CO2,故答案为:CO2;
②KI固体在空气中变质,与氧气、水、二氧化碳反应生成碳酸钾、碘,反应的方程式为4KI+O2+2CO2=2K2CO3+I2,故答案为:4KI+O2+2CO2=2K2CO3+I2.
点评 本题考查性质实验方案的设计与评价,为高频考点,题目难度中等,明确实验目的及反应原理为解答的关键,注意掌握性质实验方案的设计原则,试题侧重考查学生的分析、理解能力及化学实验能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 配0.1mol/L的标准盐酸和0.01mol•L-1的标准盐酸 | → | 用0.1mol•L-1的标准盐酸滴定未知Ba(OH)2溶液10mL用去盐酸19.60mL | → | 用Ba(OH)2溶液吸收空气中的CO2 | → | 过 滤 | → | 取滤液20mL,用0.01mol•L-1的盐酸滴定用去盐酸34.8mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是元素周期表中几种短周期主族元素原子半径随原子序数的变化.
如图是元素周期表中几种短周期主族元素原子半径随原子序数的变化.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
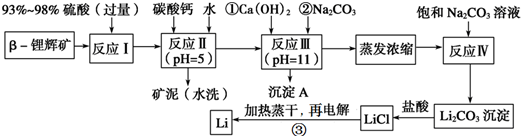
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

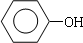 +(CH3)3CCl $\stackrel{无水AlCl_{3}}{→}$
+(CH3)3CCl $\stackrel{无水AlCl_{3}}{→}$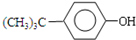 +HCl.
+HCl.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
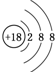 .元素⑩名称为溴在周期表中的位置第四周期第ⅦA族.
.元素⑩名称为溴在周期表中的位置第四周期第ⅦA族. .
.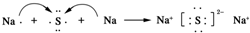 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.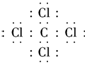 ,该化合物是由极性(填“极性”、“非极性”)键形成的.
,该化合物是由极性(填“极性”、“非极性”)键形成的.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2或N2O4的浓度不再变化 | B. | c(NO2)=c(N2O4) | ||
| C. | v正(NO2)=v逆(N2O4) | D. | NO2、N2O4的总质量不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜片电极反应:2H++2e-=H2↑ | B. | 锌片电极反应:Zn-e-=Zn2+ | ||
| C. | 铜为负极,发生还原反应 | D. | 锌为负极,发生还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com