
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)中,表示该反应速率最快的是:
3C(g)+4D(g)中,表示该反应速率最快的是:
A.V(A)=0.5mol·L-1·s-1B.V(B)=0.3mol·L-1·s-1
C.V(C)=0.8mol·L-1·s-1D.V(D)=1mol·L-1·s-1
【答案】B
【解析】
根据化学反应速率之比等于化学计量数之比,把用不同物质表示的反应速率换算成用同一物质表示的化学反应速率,然后比较大小。
在2A(g)+B(g)![]() 3C(g)+4D(g)反应中都换成B的速率进行比较;
3C(g)+4D(g)反应中都换成B的速率进行比较;
A、V(A):V(B)=2:1,V(B)=0.5mol·L-1·s-1/2=0.25 mol·L-1·s-1;
B、V(B)=0.3mol·L-1·s-1;
C、V(B):V(C)=1:3,V(B)=0.8mol·L-1·s-1/3=0.27mol·L-1·s-1;
D、V(B):V(D)=1:4,V(B)=1mol·L-1·s-1/4=0.25 mol·L-1·s-1;
比较可以知道,B表示的反应速率最块,故B正确;故答案选B。


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
【题目】如图是一种利用锂电池“固定 CO2”的电化学装置,在催化剂的作用下,该电化学装置放电时可将 CO2转化为 C 和 Li2CO3,充电时选用合适催化剂会释放出 CO2。下列说法正确的是
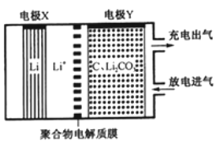
A.该电池放电时,Li+向电极 X 方向移动
B.该电池放电时,每转移 4 mol 电子,理论上生成 1mol C
C.该电池充电时,电极Y 与外接直流电源的负极相连
D.该电池充电时,阳极反应式为:C+2Li2CO3-4e- = 3CO2↑+4Li+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在铝与稀硫酸的反应中,已知10s末硫酸的浓度减少了0.9molL-1,若不考虑反应过程中溶液体积的变化,则10s内生成硫酸铝的平均反应速率是( )
A.0.03molL-1min-1B.1.8molL-1min-1
C.1.2molL-1min-1D.0.18molL-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室制取纯净、干燥的氯气,并验证氯气性质的装置。其中E瓶放有干燥红色布条;F中为红色的铜网,其右端出气管口放有脱脂棉。
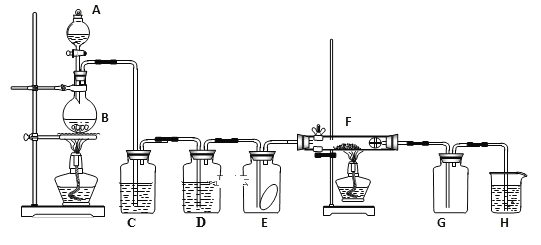
(1)写出实验室制氯气的化学方程式:___,表现还原性和酸性的盐酸物质的量之比为___。
(2)装置C中盛装的溶液是___,D中试剂的作用是___。
(3)E中的红色布条是否退色?___,F中的反应现象为____。
(4)新制氯水呈黄绿色说明其中含有____,(填化学式,下同),将AgNO3溶液滴入可观察到白色沉淀说明其中含有____。
(5)H中的试剂为___,用来吸收多余氯气。该反应的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合物H (![]() )是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:
)是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:
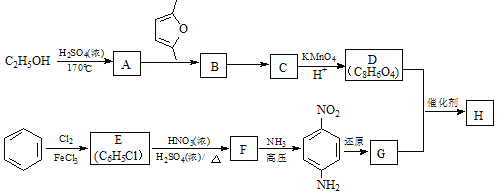
已知:①C、D、G均为芳香族化合物,分子中均只含两种不同化学环境的氢原子。
②Diels﹣Alder反应:![]() 。
。
(1)生成A的反应类型是________。D的名称是______。F中所含官能团的名称是______。
(2)B的结构简式是______;“B→C”的反应中,除C外,另外一种产物是______。
(3)D+G→H的化学方程式是___________________________________________。
(4)Q是D的同系物,相对分子质量比D大14,则Q可能的结构有_____种,其中核磁共振氢谱有4组峰,且峰面积比为1:2:2:3的结构简式为__________________________________(任写一种)。
(5)已知:乙炔与1,3﹣丁二烯也能发生Diels﹣Alder反应。请以1,3﹣丁二烯和乙炔为原料,选用必要的无机试剂合成 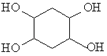 ,写出合成路线_______________________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
,写出合成路线_______________________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的镁分别在足量的二氧化碳、氧气中燃烧,有关叙述正确的是( )
A.在二氧化碳中燃烧产生的固体质量大
B.在氧气中产生的氧化镁质量大
C.氧化剂与还原剂物质的量之比都是2∶1
D.反应中都是氧元素被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应aA(g)![]() bB(g)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
bB(g)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.平衡向正反应方向移动了
B.物质B的质量分数减小了
C.物质A的转化率减小了
D.a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素非金属性强弱比较的实验研究;
乙同学设计了如图2装置来验证卤族元素性质的递变规律,A、B、C三处分别是蘸有溴化钠溶液的棉花、湿润的淀粉碘化钾试纸、湿润的红色纸条。
已知常温下浓盐酸与高锰酸钾能反应生成氯气;
可选择的试剂有:大理石、碳酸钠粉末、浓盐酸、稀硝酸、硅酸钠溶液。
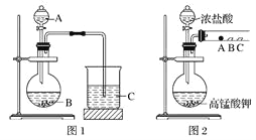
(1)甲同学实验中(图1):
①从给出试剂中选出最佳物质(填化学式):A________,B________。
②烧杯C中发生反应的离子方程式为__________________________。
(2)乙同学实验中(图2):
①写出A处反应的离子方程式________________________。
②B处实验现象是________________________。
③若高锰酸钾的还原产物为Mn2+,当有0.04 mol高锰酸钾参加反应时,则可生成标准状况下的氯气的体积为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中的原因或结论与现象不对应的是
选项 | 现象 | 原因或结论 |
A | 在H2O2中加入MnO2,能加速H2O2的分解速率 | MnO2降低了反应所需的活化能 |
B | 将盛有NO2气体的密闭容器浸泡在热水中,容器内气体颜色变深 | 2NO2(g) |
C | 在密闭容器中有反应:A+xB(g) | A为非气体、x=1 |
D | 向5mL 0.005mol·L-1FeCl3溶液中加入5mL 0.015mol·L-1 KSCN溶液,溶液呈红色,再滴加几滴1mol·L-1 KSCN溶液,溶液颜色加深 | 增大反应物浓度,平衡向正反应方向移动 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com