
分析 (1)根据n=$\frac{m}{M}$计算CO 和CO2 的物质的量之比,分子数目之比等于其物质的量之比,结合分子式计算含有原子数目之比,同温同压下,气体体积之比等于其物质的量之比;
(2)由电荷守恒,溶液中3c(Al3+)=2c(SO42-);Al2(SO4)3的浓度为$\frac{1}{3}$×0.9mol/L=0.3mol/L,根据n=cV计算硫酸铝物质的量;
(3)8gA能与32gB恰好完全反应,生成22gC和一定量D,根据质量守恒D的质量为8g+32g-22g=18g,故A、B、C、D按质量比8g:32g:22g:18g=4:16:11:9进行反应,根据质量比计算生成的D的质量,利用M=$\frac{m}{n}$计算D的摩尔质量;
(4)根据n=$\frac{m}{M}$计算氮气物质的量,氮原子物质的量为氮气的2倍,再根据N=nNA计算;
(5)根据n=$\frac{V}{{V}_{m}}$计算氢气物质的量,结合金属物质的量、电子转移守恒列方程计算解答.
解答 解:(1)根据n=$\frac{m}{M}$可知,相同质量的CO 和CO2 的物质的量之比为44g/mol:28g/mol=11:7,则二者所含分子的数目之比为11:7,含有的原子的物质的量之比为11×2:7×3=22:21,在同温同压下,二者体积之比是11:7,
故答案为:11:7;22:21;11:7;
(2)由电荷守恒,溶液中3c(Al3+)=2c(SO42-),故c(Al3+)=$\frac{2}{3}$×0.9mol/L=0.6mol/L,Al2(SO4)3的浓度为$\frac{1}{3}$×0.9mol/L=0.3mol/L,硫酸铝物质的量为0.1L×0.3mol/L=0.03mol,
故答案为:0.6;0.03;
(3)8gA能与32gB恰好完全反应,生成22gC和一定量D,根据质量守恒D的质量为8g+32g-22g=18g,故A、B、C、D按质量比8g:32g:22g:18g=4:16:11:9进行反应,由于B足量,A完全反应,则生成的D的质量为16g×$\frac{9}{4}$=36g,故D的摩尔质量为$\frac{36g}{2mol}$=18g/mol;
故答案为:18g/mol;
(4)氮气物质的量为$\frac{1g}{28g/mol}$=$\frac{1}{28}$mol,氮原子物质的量为氮气的2倍,则$\frac{1}{28}$mol×2×NA=x,故NA=14x mol-1,
故答案为:14x mol-1;
(5)氢气物质的量为$\frac{3.136}{22.4}$mol=0.14mol,设Na、Al物质的量分别为xmol、ymol,则:
$\left\{\begin{array}{l}{x+y=0.2}\\{x+3y=0.14×2}\end{array}\right.$
解得x=0.16、y=0.04
则钠和铝的物质的量之比为0.16mol:0.04mol=4:1,
故答案为:4:1.
点评 本题考查物质的量有关计算、化学方程式计算等,注意公式的灵活运用与基础知识的掌握.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-═Fe(OH)2↓ | |
| B. | ${\;}_{94}^{238}$Pu与${\;}_{92}^{238}$U互为同位素 | |
| C. | H3O+和NH4+具有的电子数相同 | |
| D. | 用BaCl2溶液鉴别AgNO3溶液和K2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向 FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| B. | NaClO溶液 FeCl2溶液混合 2ClO-+Fe2++2H2O=Fe(OH)2↓+2HClO | |
| C. | 在强碱中NaClO与Fe(OH)3生成Na2FeO4:3ClO-+2Fe(OH)3═2FeO${\;}_{4}^{2-}$+3Cl-+H2O+4H+ | |
| D. | 用铜做电极电解 CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu↓+O2↑+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤⑥ | B. | ①②⑤⑥⑦ | C. | ①③④⑥ | D. | ②⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电解过程中,d电极附近溶液变红 | |
| B. | c电极上的电极反应式为:2H++2e-=2H2↑ | |
| C. | a为负极、d为阳极 | |
| D. | 电解过程中,氯离子浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
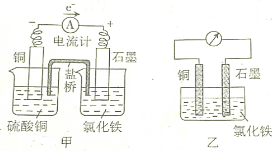
| A. | 甲、乙装置中的负极(或正极)反应式不同 | |
| B. | 放电少许时间后,甲、乙装置石墨极质量均增加 | |
| C. | 放电少许时间后,甲装置左边烧杯中含有两种溶质 | |
| D. | 甲、乙装置的能量转化形式不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9:3:4 | B. | 3:1:2 | C. | 2:1:3 | D. | 3:2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com