
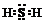 .
.| 操作 | 现象 |
| ①取B的溶液加入过量浓 NaOH溶液并加热 | 产生白色沉淀和无色刺激性气味气体; 过一段时间白色沉淀变为灰绿色,最终变为红褐色; |
| ②另取B的溶液, 加入过量BaCl2溶液 | 产生白色沉淀,加盐酸沉淀不溶解 |
分析 (1)原子序数由小到大排列的四种短周期元素X、Y、Z、W,在周期表中X是原子半径最小的元素,则X为H元素;Z、W位于同主族,设Z的原子序数为x,则W的原子序数为x+8,Y、Z左右相邻,Y的原子序数为x-1,由四种元素的原子序数之和为32,则1+(x-1)+x+(x+8)=32,解得x=8,即Y为N元素,Z为O元素,W为S元素;
(2)硫化氢属于共价化合物,分子中S原子与H原子之间形成1对共用电子对,
(3)由H、N、O、S四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,该酸为硝酸,稀硝酸与Cu反应生成硝酸铜、NO与水;
(4)由H、N、O、S四种元素组成的一种离子化合物A:
①1molA能与足量NaOH浓溶液反应生成标准状况下44.8L气体,说明该物质阳离子为NH4+,且1molA中含有2molNH4+,则A为硫酸铵或亚硫酸铵,铵根离子与氢氧根离子反应生成氨气;
②A既能与盐酸反应,又能与氯水反应,故A为亚硫酸铵;
(5)由H、N、O、S和Fe五种元素组成的式量为392的化合物B,由B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体.过一段时间白色沉淀变为灰绿色,最终变为红褐色,可知B中含有Fe2+、NH4+.另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解,则B中含有硫酸根离子,又1mol B中含有6mol结晶水,令B的化学式为x(NH4)2SO4•yFeSO4•6H2O,结合其相对分子质量确定.Fe2+被氧化为Fe3+,根据电子转移守恒计算Mn元素在还原产物中化合价,确定还原产物,配平书写离子方程式.
解答 解:(1)原子序数由小到大排列的四种短周期元素X、Y、Z、W,在周期表中X是原子半径最小的元素,则X为H元素;Z、W位于同主族,设Z的原子序数为x,则W的原子序数为x+8,Y、Z左右相邻,Y的原子序数为x-1,由四种元素的原子序数之和为32,则1+(x-1)+x+(x+8)=32,解得x=8,即Y为N元素,Z为O元素,W为S元素,
故答案为:H;
(1)硫化氢属于共价化合物,分子中S原子与H原子之间形成1对共用电子对,电子式为: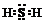 ,
,
故答案为: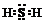 ;
;
(3)由H、N、O、S四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,该酸为硝酸,稀硝酸与Cu反应生成硝酸铜、NO与水,反应离子方程式为:3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O,
故答案为:3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O;
(4)①1molA能与足量NaOH浓溶液反应生成标准状况下44.8L气体,说明该物质阳离子为NH4+,且1molA中含有2molNH4+,则A为硫酸铵或亚硫酸铵,铵根离子与氢氧根离子反应生成氨气,反应离子方程式为NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,
故答案为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;
②A既能与盐酸反应,又能与氯水反应,故A为亚硫酸铵,A与氯水反应的离子方程式:SO32-+Cl2+H2O=SO42-+2Cl-+2H+,
故答案为:SO32-+Cl2+H2O=SO42-+2Cl-+2H+;
(5)由H、N、O、S和Fe五种元素组成的式量为392的化合物B,由B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体.过一段时间白色沉淀变为灰绿色,最终变为红褐色可知B中含有Fe2+、NH4+,另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解,则B中含有硫酸根离子,又1mol B中含有6mol结晶水,令B的化学式为x(NH4)2SO4•yFeSO4•6H2O,则:(96+36)x+(96+56)y+108=392,则x=y=1,故B的化学式为:(NH4)2SO4•FeSO4•6H2O,
B的物质的量为0.1L×1mol/L=0.1 mol,溶液中Fe2+为0.1mol,被氧化为Fe3+,高锰酸根离子的物质的量为0.02L×1mol/L=0.02 mol,设Mn元素在还原产物中化合价为a,根据电子转移守恒,0.1mol×(3-2)=0.02mol×(7-a),解得a=2,即含有生成Mn2+,故离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,
故答案为:(NH4)2SO4•FeSO4•6H2O;5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O.
点评 本题考查位置结构性质的应用、无机物推断等,明确Y、Z、W的位置及原子序数的关系来推断元素是关键,需要学生熟练掌握元素化合物性质,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 6:1 | B. | 3:1 | C. | 3:4 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为除去FeSO4溶液中的Fe2(SO4)3,可加入铁粉,再过滤 | |
| B. | SO2使溴水褪色,不能说明SO2具有漂白性 | |
| C. | HCl、NO2溶于水都有化学键断裂,但不全属于化学变化 | |
| D. | 为除去CO2中少量的SO2,可使其通过饱和Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2与水反应是水作还原剂的氧化还原反应 | |
| B. | 过氧化钠的电子式为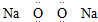 | |
| C. | 在过氧化钠与水的反应中,每生成0.1 mol氧气,转移电子的数目为0.4NA | |
| D. | 二氧化碳通过Na2O2粉末,反应后固体物质增重 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应是放热还是吸热要由反应物和生成物所具有的总能量来决定 | |
| B. | 放热的反应在常温下一定很容易发生 | |
| C. | 若用50mL 0.55mo1•L-1的氢氧化钠溶液,分别与50mL 0.50mo1•L-1的盐酸和 50mL 0.50mo1•L-1的硫酸充分反应,两反应测定的中和热是相等的 | |
| D. | 在101KPa时,1mol碳完全燃烧生成二氧化碳气体时放出的热量为碳的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 装运乙醇的包装箱上应贴上易燃液体的危险品标志图标 | |
| B. | 用点燃的火柴在液化气钢瓶口检验是否漏气 | |
| C. | 实验时,将水倒入浓硫酸中配制稀硫酸 | |
| D. | 进入煤矿井时,用火把照明 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com