
向等物质的量浓度的NaOH和Ca(OH)2的混合液中通入一定量CO2。下列离子方程式与事实不相符的是
A.OH-+CO2 → HCO3-
B.2OH-+CO2 → CO32-+H2O
C.Ca2++2OH-+CO2 → CaCO3↓+H2O
D.Ca2++4OH-+2CO2 → CaCO3↓+CO32-+2H2O
科目:高中化学 来源:2014-2015学年天津市七校高三4月联考化学试卷(解析版) 题型:实验题
(共16分)硫有多种含氧酸,亚硫酸(H2SO3)、硫酸(H2SO4)、焦硫酸(H2SO4·SO3)、硫代硫酸(H2S2O3)等等,在工业上有广泛的应用。它们对应的钠盐同样也是重要的化工产品。
(一).硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革的还原剂,它受热、遇酸易分解。工业上常利用含硫废水生产Na2S2O35H2O,实验室可用如下装置(略去部分加持仪器)模拟生成过程。

烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)= Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)= 3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq) Na2S2O3(aq) (Ⅲ)
Na2S2O3(aq) (Ⅲ)
(1)烧瓶A中发生反应的离子方程式为:_______________________________。
装置D的作用是 。
(2)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 。
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(3)反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器还有 。
a.烧杯 b.蒸发皿 c.试管 d.锥形瓶
(4)为了保证硫代硫酸钠的产量,实验中通入SO2不能过量,原因是__________________。
(二)焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。Na2S2O5溶于水即生成NaHSO3。
(5)证明NaHSO3溶液中HSO3- 的电离程度大于水解程度,可采用的实验方法是 (填序号)。
a.测定溶液的pH
b.加入Ba(OH)2溶液
c.加入盐酸
d.加入品红溶液
e.用蓝色石蕊试纸检测
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为 g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测得结果 (填“偏高”“偏低”或“不变”)。
其原因是 (用化学方程式表示)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省绵阳市高三第三次诊断性考试理综化学试卷(解析版) 题型:实验题
“摩尔盐”[ (NH4)2Fe(SO4)2·6H2O ] 是分析化学中的重要试剂。查阅文献得知:“摩尔盐”隔绝空气加热至500℃时可完全分解,但产物复杂。某学习小组欲探究其分解产物。
Ⅰ.【提出猜想】摩尔盐受热分解,小组同学认为分解产物可能有以下几种情况:
a.Fe2O3、SO3、NH3、H2O b.FeO、NH3、SO3、H2O
c.FeO、SO2、NH3、H2O d.Fe2O3、NH3、SO2、SO3、H2O
经认真分析,通过推理即可确定,猜想 不成立(填序号)。
Ⅱ.【实验探究】为检验分解产物,甲同学设计了如下实验装置。
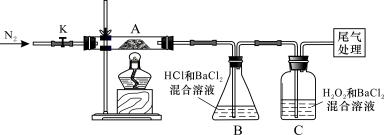
请回答下列问题:
(1)B装置的容器名称是 。
(2)取一定量“摩尔盐”置于加热管A中,加热至分解完后打开K,再通入N2,目的是 。
(3)观察到A中固体逐渐变为红棕色,B、C中均产生白色沉淀。C中发生反应的离子方程式为_________________________。
(4)待A中剩余固体冷却至室温后,取少量置于试管中,加入稀硫酸溶解,再滴几滴KSCN溶液,可以观察到的现象是 。
(5)乙同学设计实验验证A中残留物不含FeO,操作方法及实验现象是:取少量A中残留物放入试管中, 。
Ⅲ.【实验反思】
乙同学认为:装置B中产生白色沉淀不能证明分解产物中一定含SO3,原因是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省达州市第二次诊断性测试化学试卷(解析版) 题型:选择题
设NA代表阿佛加德罗常数的值,下列说法正确的是
①1 L pH=1的硫酸溶液中含有的H+数为0.2NA
②标准状况下,2.24 L乙烯和丙烯的混合气体中含有的碳原子总数0.2 NA
③7.2 g CaO2晶体中阴离子和阳离子总数为0.3 NA
④反应3H2(g)+N2(g)  2NH3(g)ΔH=-92 kJ/mol放出热量9.2 kJ时,转移电子数0.6 NA
2NH3(g)ΔH=-92 kJ/mol放出热量9.2 kJ时,转移电子数0.6 NA
⑤常温常压下,1mol氦气含有的核外电子数为4NA
⑥常温常压下,1mol甲基(—14CH3)中所含的中子数为8NA
A.① ② B.④ ⑤ C.④ ⑥ D.③ ⑤
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闵行区高三下学期质量调研考试(二模)化学试卷(解析版) 题型:简答题
(本题共12分)碘及其化合物可广泛用于医药和工业生产等。回答下列问题:
1.实验室用海带提取I2时操作步骤依次为:灼烧、溶解、过滤、_______、_______及蒸馏。
2.灼烧海带时除需要三脚架、酒精灯、玻璃棒外,还需要的实验仪器是______________。
3.“过滤”后溶液中含一定量硫酸盐和碳酸盐。现要检验溶液中的I-,需选择的试剂组合及其先后顺序是_____________。(选填编号)
a.AgNO3溶液 b.Ba(NO3)2溶液 c.BaCl2溶液 d.CaCl2溶液
4.在海带灰滤液中加入适量氯水后一定存在I2,可能存在IO3—。
请补充完整检验含I2溶液中是否含有IO3—的实验方案(可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液):
①取适量含I2溶液用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出有碘单质存在;
②_____________________________________________________________________。
5.分解水可用SO2/I2循环法。该法共涉及三步化学反应。
___________________;2H2SO4  2SO2↑+ O2↑+ 2H2O;____________________。
2SO2↑+ O2↑+ 2H2O;____________________。
与传统的分解水的方法相比,本法的优点是____________;缺点是_____________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闵行区高三下学期质量调研考试(二模)化学试卷(解析版) 题型:选择题
模拟侯氏制碱法原理,在CaCl2浓溶液中通入NH3和CO2可制得纳米级材料,装置见图示。下列说法正确的是
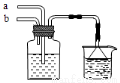
A.a通入适量的CO2,b通入足量的NH3,纳米材料为Ca(HCO3)2
B.a通入足量的NH3,b通入适量的CO2,纳米材料为Ca(HCO3)2
C.a通入适量的CO2,b通入足量的NH3,纳米材料为CaCO3
D.a通入少量的NH3,b通入足量的CO2,纳米材料为CaCO3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闵行区高三下学期质量调研考试(二模)化学试卷(解析版) 题型:选择题
常温下,往饱和石灰水中加入一定量的生石灰,一段时间后恢复到原温度,以下叙述错误的是
A.有溶质析出 B.溶液中Ca2+的数目不变
C.溶剂的质量减小 D.溶液的pH不变
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省鹰潭市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
在某恒容密闭容器中进行如下可逆反应:2A(g) + B(g)  C(?) +2Q(g) ΔH<0,起始投料只有A和B。下列示意图一定正确且能表示该可逆反应达到平衡状态的是
C(?) +2Q(g) ΔH<0,起始投料只有A和B。下列示意图一定正确且能表示该可逆反应达到平衡状态的是
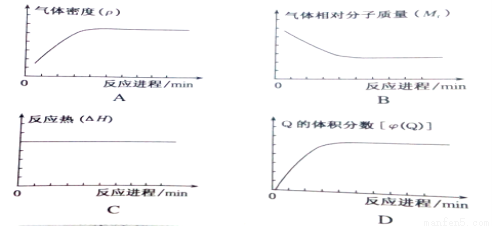
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省怀化市高三学业水平模拟考试化学试卷(解析版) 题型:选择题
下列关系互为同分异构体的是
A.35 Cl和37 Cl B.CH3CH2OH和CH3OCH3
C.CH3CH3和CH3CH2CH3 D.H2O和H2O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com