
| A. | ①②③ | B. | ①⑤⑥ | C. | ①②④ | D. | ③⑤⑥ |
分析 根据价层电子对互斥理论确定中心原子杂化类型,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$×(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数.可用sp3杂化轨道来解释说明中心原子含有4个价层电子对,孤对电子对成键电子的排斥作用较强,键角减小,据此分析判断.
解答 解:①CH4中碳原子价层电子对个数=4+$\frac{4-4}{2}$=4,为sp3杂化,不含孤电子对,所以空间构型是正四面体形,其键角为109°28′,可用sp3杂化轨道来解释,故①选;
②NH3分子中价层电子对个数=3+$\frac{1}{2}$(5-3×1)=4,中心原子杂化类型分别为sp3,中心原子含有1个孤电子对,空间构型为三角锥,孤对电子对成键电子的排斥作用较强,键角减小,其键角为107°,故②选;
③H2O中心原子O原子成2个σ键、含有$\frac{6-1×2}{2}$=2对孤对电子,价层电子对个数=σ键个数+孤电子对个数=2+2=4,杂化轨道数为4,采取sp3杂化,H2O分子的立体构型是V形,其键角为104.5°,故③选;
④CH≡CH分子中每个碳原子形成1个C-H,1个C≡C三键,碳原子价层电子对个数=2+$\frac{1}{2}$(4-4×1)=2,每个碳原子杂化轨道数为2,所以采取sp杂化,其分子的立体构型是直线形,其键角为180°,故④不选;
⑤苯分子中碳原子价层电子对个数=3+$\frac{1}{2}$(4-4×1)=3,杂化轨道数为3,所以采取sp2杂化,其分子的立体构型是平面正六边形,其碳碳键角为120°,故⑤不选;
⑥CH2═CH2 分子中碳原子价层电子对个数=3+$\frac{1}{2}$(4-4×1)=3,每个碳原子杂化轨道数为3,所以采取sp2杂化,其分子的立体构型是平面形,其碳氢键与碳碳键夹角约为120°,故⑥不选;
故选A.
点评 本题考查了原子杂化类型的判断,根据价层电子对互斥理论来分析解答,注意孤电子对个数=$\frac{1}{2}$(a-xb)中各个字母的含义,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 属于放热反应 | B. | 属于氧化还原反应 | ||
| C. | 属于复分解反应 | D. | 属于离子反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol任何气体的摩尔体积都约是22.4L | |
| B. | 标准状况时,体积均为22.4 L的O2与CO2含有相同的分子数 | |
| C. | 处于标准状况的两种气体,当体积均为22.4L时的质量完全相同 | |
| D. | 标准状况时,2mol任何物质的体积均约为44.8L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MnO4-.>Cl2>Fe3+>Cu2+>Fe2+ | B. | Fe3+>MnO4->Cl2>Cu2+>Fe2+ | ||
| C. | Cl2>MnO4->Fe3+>Cu2+>Fe2+ | D. | Cu2+>Cl2>MnO4->Fe3+>Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
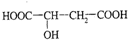 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com