
![]()
已知常压下SO3体积分数为91%,试回答:?
(1)在生产中常用过量的空气是为了 。?
(2)加热到400~
(3)压强应采用(填“高压”或“常压”) ,原因是? 。?
(4)常用浓H2SO4来吸收SO3,而不是用水,是因为 。?
(5)尾气中的SO2必须回收,是因为 。?
解析:本题主要考查在硫酸工业生产中,运用勒夏特列原理选择SO2转化为SO3的适宜条件的能力。?
(1)从增大某一反应物浓度,使平衡向生成物方向移动,另一反应物的转化率必提高去分析。
(2)温度的选择从反应速率快慢、催化剂的活性温度两方面考虑。?
(3)压强从对平衡移动、设备及动力系统的要求两方面考虑。?
(4)从吸收过程中发生的反应对吸收速率的影响去?分析。??
(5)从环境保护方面考虑。?
答案:(1)增大氧气的浓度,使平衡向正反应方向移动,提高了二氧化硫的转化率,使成本高的二氧化硫得到充分?利用??
(2)400~500 ℃是催化剂的活性温度,选择此温度可提高反应速率,缩短到达平衡所需的时间?
(3)常压因为常压下SO3体积分数已达91%,若再加压对设备及动力系统要求高、成本高,使生产效益低?
(4)用水吸收SO3会形成酸雾,使吸收的速率减慢?
(5)SO2有毒。避免对环境的污染?


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:同步题 题型:填空题
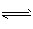 2SO3(g) △H <0。已知常压下SO3体积分数为91%,试回答:
2SO3(g) △H <0。已知常压下SO3体积分数为91%,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
(1)在生产中常用过量的空气是为了___________________。
(2)加热到400—500 ℃是由于___________。
(3)压强应采用__________ (填“高压”或“常压”)。原因是____________________________。
(4)常用浓H2SO4来吸收SO3,而不是用水,是因为____________________。
(5)尾气中的SO2必须回收,是因为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)在生产中常用过量的空气是为了______________________________________________。
(2)加热到400—
(3)压强应采用____________________(填“高压”或“常压”)。原因是___________________。
(4)常用浓H2SO4来吸收SO3,而不是用水,是因为___________________________________。
(5)尾气中的SO2必须回收,是因为______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com