
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容,下列说法正确的是 ( )

A.该硫酸的物质的量浓度为9.2 mol/L
B.1 mol Zn与足量的该硫酸反应产生2 g氢气
C.配制200 mL 4.6 mol/L的稀硫酸需取该硫酸50.0 mL
D.该硫酸与等质量的水混合所得溶液的物质的量浓度大于9.2 mol/L
 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
例1、关于某无色溶液中所含离子的鉴别,下列判断正确的是 ( )
A.加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不溶解时,可确定有Cl-存在
B.通入Cl2后,溶液变为深黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在
C.加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸后沉淀不溶解时,可确定有SO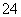 存在
存在
D.加入稀盐酸,生成的气体能使澄清石灰水变浑浊,可确定有CO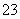 存在
存在
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子 方程式正确的是( )
方程式正确的是( )
A.Cl2通入水中:Cl2+H2O = 2H++Cl-+ClO-
B.双氧水加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+2H2O
C.用铜做电极电解CuSO4溶液:2Cu2++2H2O 2Cu+O2↑+4H+
2Cu+O2↑+4H+
D.Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+=SO42-+3S↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
类推是化学研究中常用的一种思维方式,下列有关离子反应方程式的类推正确的是 ( )
| 已知 | 类推 | |
| A | 向次氯酸钙溶液中通CO2气体:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | 向次氯酸钙溶液中通SO2气体:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
| B | 用惰性电极电解硫酸铜溶液:2Cu2++2H2O | 用铜电极电解硫酸铜溶液:2Cu2++2H2O |
| C | 稀硫酸与Ba(OH)2溶液反应,pH=7时,2H++SO | 硫酸氢钠溶液与Ba(OH)2溶液反应,pH=7时,2H++SO |
| D | Ba(OH)2溶液逐滴滴入硫酸铝钾溶液至沉淀质量达到最大值:2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O | Ba(OH)2溶液逐滴滴入硫酸铝铵溶液至沉淀质量达到最大值:2Ba2++4OH-+Al3++2SO42- =2BaSO4↓+AlO2- +2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能 大量共
大量共 存的是 ( )
存的是 ( )
A.0.1 mol·L-1 NaOH溶液:K+、Na+、SO 、CO
、CO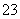
B.0.1 mol·L-1 Na2CO3溶液:K+、Ba2+、NO 、Cl-
、Cl-
C.0.1 mol·L-1 FeCl3溶液:K+、NH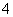 、I-、SCN-
、I-、SCN-
D.c(H+)/c(OH-)=1×1014的溶液:Ca2+、Na+、ClO-、NO
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏伽德罗常数 的数值。下列说法正确的是
的数值。下列说法正确的是
A.1mol甲苯含有6NA个C-H键
B.18gH2O含有10NA个质子
C.标准状况下,22.4L氨水含有NA个NH3分子
D.56g铁片投入足量浓硫酸中生成NA个SO2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于同温同压下的两种气体12C18O和14N2的判断正确的是( )
A.体积相等时密度相等 B.原子数相等时具 有的中子数相等
有的中子数相等
C.体积相等时具有的电子数相等 D.质量相等时具有的质子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
漂白粉是一种常用的消毒剂。
(1)工业上生产漂白粉反应的化学方程式为__________________________________________
________________________________________________________________________,
漂白粉的有效成分为________。
(2)某探究小组从市场上购买了一袋包装破损的漂白粉,对该漂白粉的成分进行探究。根据下列试剂,设计实验方案,进行实验。请在答题卡上完成实验报告。
限选试剂:2 mol·L-1 NaOH溶液 、2 mol·L-1 HCl溶液、2 mol·L-1 HNO3溶液、0.5 mol·L-1 BaCl2溶液、0.01 mol·L-1 AgNO3溶液、澄清石灰水、石蕊试液、酚酞试液、蒸馏水。
、2 mol·L-1 HCl溶液、2 mol·L-1 HNO3溶液、0.5 mol·L-1 BaCl2溶液、0.01 mol·L-1 AgNO3溶液、澄清石灰水、石蕊试液、酚酞试液、蒸馏水。
| 实验步骤 | 预期现象与结论 |
| 步骤1:取适量漂白粉溶于足量蒸馏水,充分搅拌,静置,过滤,得沉淀和滤液。 | |
| 步骤2:向沉淀加入适量2 mol·L-1 HCl溶液,将产生的气体通入________________________________________________________________________ ________________________________________________________________________ | 现象:________________________________________________________________________ 结论:________________________________________________________________________ |
| 步骤3:取滤液分装A、B两支试管。向A试管,________________________________________________________________________ | 现象:溶液先变红色,然后褪色。 结论:________________________________________________________________________ |
| 步骤4:向B试管,________________________________________________________________________ ________________________________________________________________________ | 现象:产生白色沉淀。 结论:________________________________________________________________________ |
(3)探究小组为测定漂白粉中Ca(ClO)2的含量:称取漂白粉b g加水溶解后配制成100 mL溶液,准确量取25.00 mL于锥形瓶并加入足量盐酸和KI溶液,充分反应后,溶液中的游离碘用0.100 0 mol/L的Na2S2O3溶液滴定,滴定2次,平均消耗Na2S2O3溶液20.00 mL。则该漂白粉中Ca(ClO)2的质量分数为________________________________________________________________________。
(只列算式,不做运算,已知:Mr[Ca(ClO)2]=143;Ca(ClO)2+4HCl===2Cl2↑+CaCl2+2H2O,2Na2S2O3+I2===Na2S4O6+2NaI)
查看答案和解析>>
科目:高中化学 来源: 题型:
发展混合动力车是实施节能减排的重要措施之一。混合动力车的电动机目前一般使用的是镍氢电池。汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态以节省能耗。镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解液.镍氢电池充放电原理如图,其总反应式为: H2+2NiOOH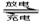 2Ni(OH)2
2Ni(OH)2
下列有关混合动力车的判断正确的是( )
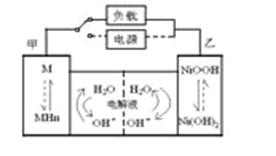
A.在上坡或加速时,每消耗22.4LH2,从电极甲流向电极乙的电子是2mol
B.在上坡或加速时,乙电极周围溶液的pH将减小
C.在刹车和下坡时,溶液中的K+向乙电极迁移
D.在刹车和下坡时,甲电极的电极反应式为2H2O+2e-=H2↑+2OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com