
| A. | 观察(得出Br2物理性质)→实验、观察→预测(推测Br2化学性质)→解释并得出结论 | |
| B. | 预测(推测Br2化学性质)→观察(得出Br2物理性质)→解释并得出结论→实验、观察 | |
| C. | 观察(得出Br2物理性质)→预测(推测Br2化学性质)→实验、观察→解释并得出结论 | |
| D. | 实验、观察→预测(推测Br2化学性质)→观察(得出Br2物理性质)→解释并得出结论 |
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、SO32-、SO42- | B. | Na+、Ca2+、Cl-、CO32- | ||
| C. | Na+、K+、OH-、Al3+ | D. | Mg2+、Fe2+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 分子式 | 外观 | 热分解温度 | 熔点 |
| CO(NH2)2•H2O2 | 白色晶体 | 45℃ | 75~85℃ |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
碳酸铵[(NH4)2C03]在室温下就能自发地分解产生氨气,对其说法中正确的是( )
A.碳酸铵分解主要是因为生成了易挥发的气体,使体系的熵增大
B.碳酸铵分解主要是因为外界给予了能量
C.碳酸铵分解是吸热反应,可根据焓变判断碳铵不能自发分解
D.碳酸盐都不稳定,都能自发分解
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
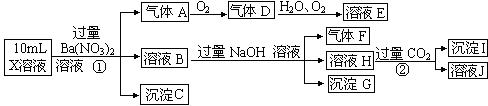
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.9mol/L | D. | 1.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
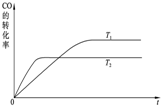 工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g).
工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g).查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲的化学式为H2O | |
| B. | 反应中甲、乙、丁的分子个数比为1:2:1 | |
| C. | 若32g乙参加反应,则生成18g丁 | |
| D. | 丁中氧元素的质量一定等于参加反应的乙的质量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com