
 一定条件下,将H2和N2置于密闭容器中进行反应:N2(g)+3H2(g)?2NH3(g)(正反应为放热反应).如图为某时刻开始,用H2、N2和NH3表示的反应速率与时间的关系图象,请运用图象信息分析并填空:
一定条件下,将H2和N2置于密闭容器中进行反应:N2(g)+3H2(g)?2NH3(g)(正反应为放热反应).如图为某时刻开始,用H2、N2和NH3表示的反应速率与时间的关系图象,请运用图象信息分析并填空:

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:
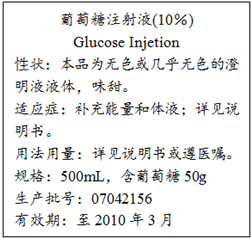 如图是某医院输液用的一瓶葡萄糖注射液标签的部分内容.据此回答以下问题(答案保留2位小数):
如图是某医院输液用的一瓶葡萄糖注射液标签的部分内容.据此回答以下问题(答案保留2位小数):查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 ”称为
”称为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、单质的还原性:Y>X |
| B、元素M与N只能形成一种共价化合物 |
| C、通常状况下,元素Z的单质不能与元素M的氧化物反应 |
| D、元素X、Y、Z的最高价氧化物对应的水化物彼此间均可发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com