
 ij�о���ѧϰС�������һ��ʵ�飬��֤Ԫ�������ɣ�
ij�о���ѧϰС�������һ��ʵ�飬��֤Ԫ�������ɣ����� ��1���ٸ���Ԫ�������ɿ�֪��ͬһ���ڣ������ң�ʧ��������������Ԫ�ؽ�����������
�����жϽ�����ǿ����Ȼ����ݽ�����Խǿ��������ˮ��ӦԽ���ң�
������ˮ��Ӧ�����������ƺ��������������ӷ���ʽ����д������д��
�ܷ�Ӧ�������ԣ�˵����Ӧ����С������Ӱ�����ʵ����ط�����
��2������ǿ���Ʊ�������У�A��ǿ�ᣬ�����¿���ͭ��Ӧ��Ϊ���B�ǿ�״���壬��Һ©���Ļ�����C�пɹ۲쵽��ɫ�������ɣ���BΪ̼��ơ�CΪ�����ƣ��Դ˽��
��� �⣺��1����ͬһ���ڣ������ң�ԭ��ʧ����������������Ԫ�ؽ�����������
�ʴ�Ϊ��������
�ڽ����ԣ�K��Na��Mg��Al��������Խǿ��������ˮ��ӦԽ���ң��ʷ�Ӧ����ҵ��ձ���D��
�ʴ�Ϊ��D��
������ˮ��Ӧ�����������ƺ���������Ӧ�����ӷ���ʽ��2Na+2H2O=2Na++2OH-+H2����
�ʴ�Ϊ��2Na+2H2O=2Na++2OH-+H2����
�ܷ�Ӧ�������ԣ�˵����Ӧ����С�������¶ȿ��Լӿ����ʣ�������ˮ��Ϊ��ˮ����ˮ��Ϊ������������Һ�������ӵ�Ũ�ȣ����Լӿ����ʣ�
�ʴ�Ϊ��BC��
��2��������ǿ���Ʊ�������У�A��ǿ�ᣬ�����¿���ͭ��Ӧ�����B�ǿ�״���壬��Һ©���Ļ�����C�пɹ۲쵽��ɫ�������ɣ���BΪ̼��ơ�CΪ�����ƻ����أ�
�ʴ�Ϊ��HNO3��Na2SiO3����K2SiO3����
����ƿ�з���������̼��Ƶķ�Ӧ������ʽΪ2HNO3+CaCO3=Ca��NO3��2+H2O+CO2����
�ʴ�Ϊ��2HNO3+CaCO3=Ca��NO3��2+H2O+CO2����
��Ԫ�صķǽ�����Խǿ����Ӧ������������ˮ���������Խǿ����ʵ���֪���ԣ��������̼�ᣬ̼����ڹ��ᣬ��ǽ����Ե���̼���裬
�ʴ�Ϊ������̼���裮
���� ���⿼������������ʵ�鷽������ƣ�������ѧ���ķ���������ʵ�������Ŀ��飬���⽫Ԫ�ؼ��仯���Ԫ����������ʵ��֪ʶ������������н�ǿ���ۺ��ԣ��ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �� | ���� | ���� | ���� | ���� |
| ����� | �ǽ��� | ������ | ���������� | |
| �������� | NaOH |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ʵ��������һδ֪Ũ�ȵ�ϡ���ᣬijѧ��Ϊ�ⶨ�����Ũ����ʵ�����н�������ʵ�飺�����������գ�
ʵ��������һδ֪Ũ�ȵ�ϡ���ᣬijѧ��Ϊ�ⶨ�����Ũ����ʵ�����н�������ʵ�飺�����������գ�| ʵ���� | NaOH��Һ��Ũ�� ��mol/L�� | �ζ����ʱ��NaOH��Һ����������mL�� | ����������Һ����� ��mL�� |
| 1 | 0.10 | 22.50 | 20.00 |
| 2 | 0.10 | 18.56 | 20.00 |
| 3 | 0.10 | 18.54 | 20.00 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
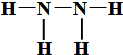
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���Ƕ������ȷ�Ӧ | B�� | a��b��c��Ϊ��ֵ | ||
| C�� | ��Ӧ�ȵĹ�ϵ��2b=c | D�� | ��Ӧ�ȵĹ�ϵ��a=b |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com