
【题目】某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。
(1)A的分子式为______________。
(2)A与溴的四氯化碳溶液反应的化学方程式为_________________________________,反应类型是________。
(3)已知:![]()
![]()
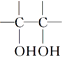 。请写出A与稀、冷的KMnO4溶液在碱性条件下反应产物的结构简式:_____________________。
。请写出A与稀、冷的KMnO4溶液在碱性条件下反应产物的结构简式:_____________________。
(4)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,写出此化合物的结构简式_________________________。
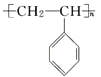
(5)在一定条件下,由A聚合得到的高分子化合物的结构简式为_______________。
【答案】C8H8![]()
![]() 加成反应
加成反应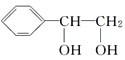
![]()
【解析】
(1)根据相对分子质量和含碳量可计算含氢量,进而计算C、H原子数目,可知分子式;
(2)该物质含有苯环,能与溴发生反应,说明A应为苯乙烯;
(3)A中含有碳碳双键,结合信息可知生成物;
(4)一定条件下,A与氢气反应,可得乙苯或乙基环己烷,结合含氢量判断;
(5)含有碳碳双键,可发生加聚反应生成聚苯乙烯。
(1)1molA中n(C)=104g×92.3%/12g·mol-1=8mol,n(H)=104g×(192.3%)/1g·mol-1=8mol,则分子式为C8H8;
(2)该物质含有苯环,能与溴发生反应,说明A应为苯乙烯,结构简式为![]() ,与溴发生加成反应生成
,与溴发生加成反应生成![]() ,则反应的方程式为
,则反应的方程式为![]() +Br2
+Br2![]()
![]() ;
;
(3)根据已知信息可知形成邻二醇结构,该醇比烯烃多两个氢原子,可知![]() 被氧化生成
被氧化生成![]() ;
;
(4)一定条件下,A与氢气反应,可得乙苯或乙基环己烷,得到的化合物中碳的质量分数为85.7%,应为![]() ,其中ω(C)=12×8/112×100%=85.7%;
,其中ω(C)=12×8/112×100%=85.7%;
(5)含有碳碳双键,可发生加聚反应生成聚苯乙烯,结构简式为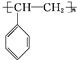 。
。


 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】现有A、B、C、D四种短周期元素,B是非金属性最强的元素,A分别与 B、C、D结合生成甲、乙、丙三种化合物,且甲、乙、丙三种分子中含相同数目的质子,乙常温下为液态化合物, C、D结合生成化合物丁。有关元素的单质和甲、乙、丙、丁四种化合物的转化关系如下图所示:

(1)写出B+乙 → 甲+C的化学反应方程式___________________________________________。
(2)根据以上条件可以确定A、B、C、D四种元素中的三种,不能被确定的第四种元素是_______。(填写序号)
①A ②B ③C ④D
(3)依据下列条件可以进一步确定上述第四种元素:① 甲与丙以及乙与丙均能够发生反应,
② 甲、丙都是无色、有刺激性气味的物质。据此,请回答下列问题:写出上述第四种元素在周期表中第_________ 周期第_________ 族;写出 C+丙 → 乙+丁 的化学反应方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】达康书记又追问环保局长:那么垃圾处理中,能随便焚烧吗?焚烧垃圾会降低GDP的。请问,在焚烧垃极过程中发生了
A. 不能,吸热非氧化还原反应 B. 能,吸热的氧化还原反应
C. 能,放热的非氧化还原反应 D. 不能,放热的氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 陶瓷、玻璃、水泥都是硅酸盐产品
B. 水晶、玛瑙、硅胶、硅石的主要成分都是SiO2
C. SiO2很稳定,与所有的酸都不反应
D. 单质硅可以用于计算机芯片和光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)海洋是一座巨大的化学资源宝库,从中可以提取许多常见的化学物质,结合所学知识回答下列问题,
(1)“吹出法”提溴空气吹出法是工业规模提溴的常用方法,其流程如下:
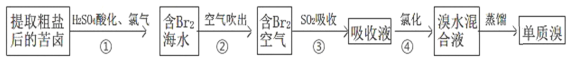
其中步骤②~④的目的是________________________________________________。步骤③反应的离子方程式为_______________________________。除SO2外,步骤③还可以选用Na2CO3溶液吸收溴,主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3(未配平),吸收1molBr2时,转移电子的物质的量为____________mol。
(2)实验室模拟从海带中提取碘,可能经历如下操作(或过程),请选择必要的操作(或过程),并按实验的先后顺序排列___________________________(填写编号)
(3)卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+和Mn2+等杂质离子。现以卤块为原料按下图流程制备轻质氧化镁,若要求产品尽量不含杂质,而且生产成本较低,请根据表1和表2提供的资料,回答下列问题:

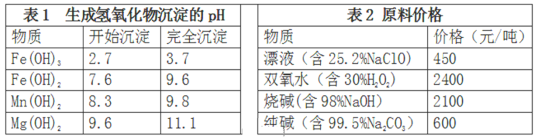
已知:Fe2+氢氧化物呈絮状,不易从溶液中除去。
步骤①反应的离子方程式为:_____________________________________;
步骤②的反应方程式为:_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态。请填写下列空白。
(1)E元素基态原子的核外电子排布式为______。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为______(填元素符号),其原因为__________________。
(3)B2A4是重要的基本石油化工原料。B2A4分子中B原子轨道的杂化类型为______;1 mol B2A4分子中含______ mol σ键。
(4)已知D、E能形成晶胞如图所示的两种化合物,化合物的化学式,甲为______,乙为______;高温时,甲易转化为乙的原因为______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在试管Ⅰ和Ⅱ中分别加入3mL稀盐酸(均足量),再将装有0.3gNaHCO3和0.3gNa2CO3粉末的小气球分别套在Ⅰ和Ⅱ的管口。各将气球内的NaHCO3、Na2CO3同时倒入试管中,回答:
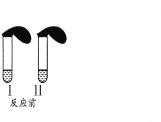
①I试管发生的离子方程式: _______________________;
②两支试管中充分反应后生成的气体总量Ⅰ_____Ⅱ,反应结束时消耗盐酸的物质的量Ⅰ_____Ⅱ(填“>”“=”或“<”)。
(2)甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度升高。由此他得出:不管其状态如何,NaHCO3和盐酸反应为吸热反应,而Na2CO3和盐酸反应为放热反应。乙同学认为甲同学的判断太武断,继续进行了下列实验(每次实验各做3次平行实验,取平均值):
序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后最高或最低温度 |
1 | 50mL水 | 2.5gNaHCO3固体 | 20℃ | 18.5℃ |
2 | 50mL水 | 3.2gNa2CO3固体 | 20℃ | 24.3℃ |
3 | 35mL稀盐酸 | 含2.5gNaHCO3的饱和溶液15mL | 20℃ | 18.8℃ |
4 | 35mL稀盐酸 | 含3.2gNa2CO3饱和溶液15mL[来 | 20℃ | 24.2℃ |
5 | 50mL稀盐酸 | 2.5gNaHCO3固体 | 20℃ | T℃ |
6 | 50mL稀盐酸 | 3.2gNa2CO3固体 | 20℃ | 25.1℃ |
通过上述实验可得出:
①Na2CO3的饱和溶液和盐酸的反应是___________(吸热或放热)反应;
②NaHCO3的饱和溶液和盐酸的反应是__________(吸热或放热)反应;
③表中⑤号试验混合后温度T℃可能是(填编号)_________________________。
A.18.5℃ B. 24.2℃ C.16.2℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )

A. 在0-a范围内,只发生中和反应
B. ab段发生反应的离子方程式为:CO32-+2H+=H2O+CO2↑
C. a=0.3
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为1:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com