
| A. | “光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化合物有关 | |
| B. | SiO2可用于制造光导纤维,其性质稳定,不溶于强酸、强碱 | |
| C. | 根据分散质微粒直径大小可以将分散系分为溶液、胶体和浊液 | |
| D. | 焰火的五彩缤纷是某些金属元素的性质的表现 |
分析 A.以一氧化氮和二氧化氮为主的氮氧化物是形成光化学烟雾和硝酸型酸雨的一个重要原因;
B.二氧化硅是酸性氧化物,能和强碱反应生成盐和水;
C.根据分散质微粒直径大小可以将分散系分为溶液、胶体和浊液;
D.根据金属元素焰色反应.
解答 解:A.以一氧化氮和二氧化氮为主的氮氧化物是形成“光化学烟雾”“硝酸型酸雨”的形成的一个重要原因,故A正确;
B.SiO2可用于制造光导纤维,其性质稳定,能和强碱反应生成盐和水,故B错误;
C.分散质微粒直径大小可以将分散系分为溶液、胶体和浊液,故C正确;
D.焰火的五彩缤纷是某些金属元素的焰色反应,故D正确;
故选B.
点评 本题考查了常见物质的用途等,侧重于常识性内容的考查,难度不大,注意基础知识的积累.


科目:高中化学 来源: 题型:解答题
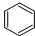 c.
c.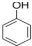
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发操作时,应将混合物中的水分蒸干后,才能停止加热 | |
| B. | 用Ba(NO3)2溶液鉴别Cl-、SO42和CO32- | |
| C. | 用氨水鉴别Al3+、Mg2+和Ag+ | |
| D. | 可以用溶解过滤的方法从加热氯酸钾和二氧化锰的混合物中获得二氧化锰 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
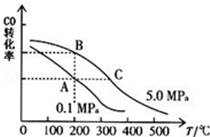 甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题
甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H>0的反应一定不能自发进行 | |
| B. | 同温、同浓度的盐酸和氢氧化钠稀溶液中,水的电离程度相同 | |
| C. | 为保护浸入海水中的钢闸门,可在闸门表面镶上铜锭 | |
| D. | 硫酸工业中二氧化硫的催化氧化[2SO2(g)+O2(g)?2SO3 (g)],不采用高压是因为压强对SO2转化率无影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝粉在氧气中燃烧生成Al2O3,故钠在氧气中燃烧生成Na2O | |
| B. | 铁能从硫酸铜溶液中置换出铜,故钠也能从硫酸铜溶液中置换出铜 | |
| C. | 活泼金属钠保存在煤油中,故活泼金属铝也保存在煤油中 | |
| D. | 钠与氧气、水等反应时钠均作还原剂,故金属单质参与反应时金属单质均作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 木材纤维和土豆淀粉遇碘水均显蓝色 | |
| B. | 食用花生油和鸡蛋清都能发生水解反应 | |
| C. | 包装用材料聚乙烯和聚氯乙烯都属于烃 | |
| D. | 经常使用一次性筷子、纸杯、塑料袋等做法能保护环境 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
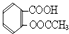 ).实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为:
).实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为:

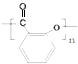 .
.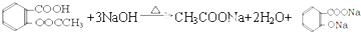 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
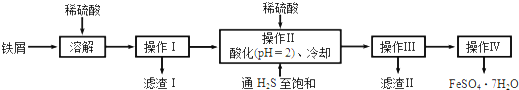
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com