
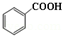
 +C2H5OH$\stackrel{H_{2}SO_{4}}{?}$
+C2H5OH$\stackrel{H_{2}SO_{4}}{?}$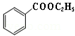 +H2O
+H2O| 沸点(℃) | 密度(g•cm-3) | |
| 苯甲酸 | 249 | 1.2659 |
| 苯甲酸乙酯 | 212.6 | 1.05 |
| 乙醇 | 78.5 | 0.7893 |
| 环已烷 | 80.8 | 0.7785 |
| 乙醚 | 34.51 | 0.7318 |
| 环已烷、乙醇和水共沸物 | 62.1 |
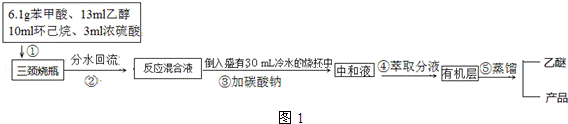
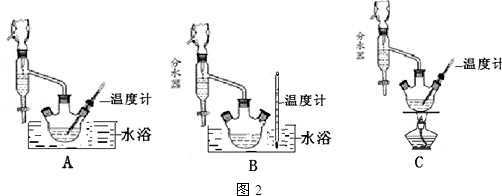
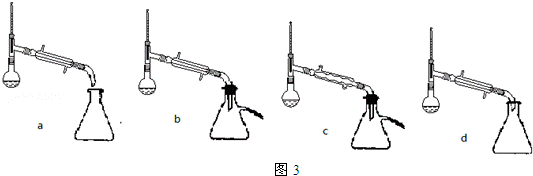
分析 (1)根据步骤②控制温度在65~70℃缓慢加热液体回流,可判断选择水浴加热的方式,要控制水浴的温度,所以温度计应测量水的温度,故选B装置,由于水-乙醇-环己烷三元共沸物,可以带出生成的水,可使酯化反应正向进行;
(2)根据反应产物可知,当反应完成时,不再产生水,分水器中下层(水层)液面不再升高,据此判断;
(3)反应物中用了苯甲酸和硫酸,所以加入碳酸钠可以中和酸,酸与碳酸钠反应可以产生泡沫,所以加入的速度不能快;
(4)苯甲酸乙酯有少量溶解中水,用乙醚可以将其萃取出来;
(5)根据防止产物挥发到空气和冷凝效果选择装置,乙醚的沸点较低,用水浴即可将其蒸出;
(6)根据6.1g苯甲酸计算苯甲酸乙酯的理论产量,产率=$\frac{实际产量}{理论产量}$×100%.
解答 解:(1)根据步骤②控制温度在65~70℃缓慢加热液体回流,可判断选择水浴加热的方式,要控制水浴的温度,所以温度计应测量水的温度;由于水-乙醇-环己烷三元共沸物,所以环己烷在本实验中的作用是可以带出生成的水,可使酯化反应正向进行,
故答案为:B;带出生成的水,促进酯化反应向正向进行;
(2)根据反应产物可知,当反应完成时,不再产生水,分水器中下层(水层)液面不再升高,所以反应完成的标志是分水器中下层(水层)液面不再升高,
故答案为:分水器中下层(水层)液面不再升高;
(3)反应物中用了苯甲酸和硫酸,所以加入碳酸钠可以中和酸,酸与碳酸钠反应可以产生泡沫,所以加入的速度不能快,
故答案为:中和苯甲酸和硫酸;加入过快大量泡沫的产生可使液体溢出;
(4)苯甲酸乙酯有少量溶解中水,用乙醚可以将其萃取出来,以提高产率,
故答案为:萃取出水层中溶解的苯甲酸乙酯,提高产率;
(5)根据防止产物挥发到空气和冷凝效果选择装置b或d都可以,不能选c的原因是用球形冷凝管冷凝的液体部分聚积在球形管里.乙醚的沸点较低,用水浴即可将其蒸出,
故答案为:bd;水浴加热;
(6)苯甲酸乙酯的理论产量为$\frac{6.1g}{122g/mol}×151g/mol$=7.55g,故产率=$\frac{6.75g}{7.55g}$×100%=90%,
故答案为:90%.
点评 本题考查了物质制备方案的设计,题目难度中等,明确制备原理为解答关键,试题涉及酯化反应原理、化学实验基本操作方法、化学平衡的影响因素等知识,注意掌握物质制备方案的设计及评价原则,试题充分考查了学生的分析能力、理解能力及化学实验能力.


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)3胶体有丁达尔效应是Fe(OH)3胶体区别于FeCl3溶液最本质的特征 | |
| B. | 阳光穿透清晨的树林时形成的光柱,是胶体的丁达尔效应的体现 | |
| C. | 鸡蛋清溶液分类上属于悬浊液 | |
| D. | 向FeCl3溶液中加入NaOH溶液,会出现红褐色Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一种化合物 | B. | 两种酸性氧化物 | ||
| C. | 两种化合物 | D. | 一种单质和一种化合物的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
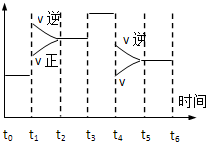 密闭体系中发生下列反应N2(g)+3H2(g)?2NH3 △H<0,如图是某一时间段中反应速率与反应进程的曲线关系图,下列各时间段内,氮气的百分含量最高的是( )
密闭体系中发生下列反应N2(g)+3H2(g)?2NH3 △H<0,如图是某一时间段中反应速率与反应进程的曲线关系图,下列各时间段内,氮气的百分含量最高的是( )| A. | t0~t1 | B. | t2~t3 | C. | t3~t4 | D. | t5~t6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2是氧化剂,KOH是还原剂 | |
| B. | KOH是氧化剂,Cl2是还原剂 | |
| C. | KCl是还原产物,KClO3是氧化产物 | |
| D. | 被氧化的氯原子与被还原的氯原子数之比为5:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com