
| A. | 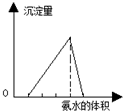 图可表示向酸化的AlCl3溶液中逐滴加入稀氨水,沉淀量与氨水体积的关系 | |
| B. | 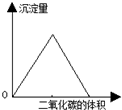 图中可表示向澄清石灰水中通入二氧化碳气体,沉淀量与二氧化碳体积的关系 | |
| C. |  图中可表示向亚硫酸溶液中通入硫化氢,沉淀量与硫化氢气体的关系 | |
| D. | 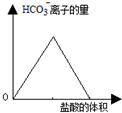 图中可表示向碳酸钠溶液中逐滴加入稀盐酸,HCO3-离子的量与盐酸体积的关系 |
分析 A、混有少量稀盐酸的AlCl3溶液中逐滴加入过量的氨水,氨水先与盐酸反应生成氯化铵,再与氯化铝反应生成氢氧化铝沉淀,沉淀不能溶解在过量氨水中,据此分析B、澄清石灰水中通入过量二氧化碳,先发生氢氧化钙与二氧化碳的反应生成碳酸钙沉淀,再发生碳酸钙与水、二氧化碳反应,沉淀消失,根据方程式判断前后两部分二氧化碳的物质的量关系;
C、向亚硫酸溶液中通入硫化氢,发生反应生成硫沉淀,硫沉淀不能与过量的硫化氢反应;
D、向碳酸钠溶液中逐滴加入稀盐酸,碳酸根先与氢离子反应生成碳酸氢根离子,后碳酸氢根继续与氢离子发生反应生成二氧化碳和水.
解答 解:A、向酸化的AlCl3溶液中逐滴加入稀氨水,氨水先与酸反应,再与氯化铝反应生成氢氧化铝沉淀,沉淀不能溶解在过量氨水中,发生的反应为3NH3•H2O+H+=NH4++H2O,3NH3•H2O+Al3+=3NH4++Al(OH)3↓,故A错误;
B、石灰水中通入二氧化碳,先发生Ca(OH)2+CO2═CaCO3↓+H2O,生成沉淀,后发生CO2+CaCO3+H2O═Ca(HCO3)2,故先产生沉淀,后沉淀溶解,前后两部分二氧化碳的物质的量为1:1,故B正确;
C、向亚硫酸溶液中通入硫化氢,发生反应生成硫沉淀,硫沉淀不能与过量的硫化氢反应,故先产生沉淀,后沉淀不变,故C正确;
D、向碳酸钠溶液中逐滴加入稀盐酸,碳酸根先与氢离子反应生成碳酸氢根离子,后碳酸氢根继续与氢离子发生反应生成二氧化碳和水,反应离子方程式为:CO32-+H+═HCO3-,HCO3-+H+═CO2+H2O,所以碳酸氢根先增大后减小,前后两部分盐酸体积为1:1,故D正确;
故选:A.
点评 本题以图象为载体考查钙铝化合物的性质、碳酸盐的性质等,难度中等,明确发生的化学反应是解答的关键,反应发生的先后顺序是学生解答中的难点,注意图象比例关系.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 在原电池中,物质在负极发生氧化反应 | |
| B. | 在原电池中,电子由负极流向正极 | |
| C. | 在电解池中,物质在阳极发生还原反应 | |
| D. | 在电解池中,与电源负极相连的电极是阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na2S溶液中加入少量FeCl3溶液:2Fe3++S2-→2Fe2++S↓ | |
| B. | 向NaOH溶液中滴加碳酸氢钙溶液至OH-恰好完全反应:Ca2++2OH-+2HCO3-→CaCO3↓+2H2O+CO32- | |
| C. | 向NaClO溶液中通入少量SO2气体:ClO-+SO2+H2O→SO42-+Cl-+2H+ | |
| D. | Na2CO3溶液中滴入少量邻羟基苯甲酸溶液: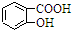 +CO32-→ +CO32-→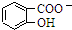 +HCO3- +HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度T (℃) | 600 | 800 | 900 | 1000 | 1200 |
| 平衡常数 K | 7.2 | 4.8 | 4.0 | 2.4 | 0.16 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 世博园区公共交通使用的是纯电动汽车 | |
| B. | 日本馆的外壳使用非晶硅薄膜,以充分利用太阳能 | |
| C. | 为了方便游客园区发放一次性塑料袋 | |
| D. | 世博停车场安装催化光解设施,可将汽车尾气中CO和NOx反应生成无毒气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
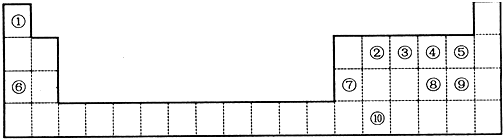
 ,元素②形成的最高价氧化物的结构式为O=C=O;
,元素②形成的最高价氧化物的结构式为O=C=O;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④、③ | B. | ④、② | C. | ①、② | D. | ③、① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 镓(Ga)、锗(Ge)、砷(As)、硒(Se)均为第四周期的元素,它们在高科技尖端科学特别是信息领域有着广泛的用途.试回答下列问题:
镓(Ga)、锗(Ge)、砷(As)、硒(Se)均为第四周期的元素,它们在高科技尖端科学特别是信息领域有着广泛的用途.试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com