
| A. | 将金粉和铁粉混合 | B. | 将牛奶加入水中混合 | ||
| C. | 蒸发食盐水制取食盐晶体 | D. | 用漏斗、滤纸过滤除去水中的泥沙 |
分析 在太空中飞行的飞船,舱内物体处于失重状态.在这种题目中,主要是看哪一种工具是利用重力来工作,与重力有关的现象不能完成.
解答 解:A、将金粉和铁粉混合,与重力现象无关,故A正确;
B、由于微粒是不断运动的,因此在太空实验室同样可以实现牛奶掺水的稀释,故B正确;
C、先将粗盐溶解在水里(需搅拌),再过滤蒸发,然后蒸发即可制得食盐晶体,与重力现象无关,故C正确;
D、采取过滤的方法除去水中泥沙时,需要在重力作用下使水通过滤纸而达到过滤的目的,而在无重力的太空实验室很难完成该操作,故D错误;
故选D.
点评 本题考查了学生对实验中所涉及变化的理解,及分析问题的能力,通过比较所涉及的实验,结合题目假设的情境,对实验的结果进行判断,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Mg失火不能用CO2灭火;Na失火也不能用CO2灭火 | |
| B. | Fe3O4可写成FeO•Fe2O3;Pb3O4也可写成PbO•Pb2O3 | |
| C. | Cu与Cl2直接化合生成CuCl2;Cu与S直接化合得到CuS | |
| D. | CO2通入到硝酸钡溶液中不能生成沉淀;SO2通入到硝酸钡溶液中也不能生成沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸与NaOH溶液反应的离子方程式为:H++OH-═H2O | |
| B. | 金属钠与乙醇反应的化学方程式为:2Na+2CH3CH2OH→2CH3CH2ONa+H2↑ | |
| C. | 聚氯乙烯的结构简式为: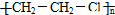 | |
| D. | 氯化铵的电子式为: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在c(HCO3-)=0.1 mol•L-1的溶液中:NH4+、AlO2-、Cl-、NO3- | |
| B. | 在由水电离出的c(H+)=1×10-12 mol•L-1的溶液中:Fe2+、ClO-、Na+、SO42- | |
| C. | KW/c(H+)=10-10 mol•L-1的溶液中:Na+、HCO3-、Cl-、K+ | |
| D. | 在使红色石蕊试纸变蓝的溶液中:SO32-、CO32-、Na+、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
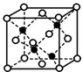 前四周期A、B、C、D、E、F、G原子序数依次增大,A元素的质子数和质量数相等,B元素具有三个能级且所排电子数相同,D元素2p能级上电子数是2s能级的两倍;D和E相邻且同主族.F是第四周期未成对电子最多的原子,G是目前使用量最多的金属.
前四周期A、B、C、D、E、F、G原子序数依次增大,A元素的质子数和质量数相等,B元素具有三个能级且所排电子数相同,D元素2p能级上电子数是2s能级的两倍;D和E相邻且同主族.F是第四周期未成对电子最多的原子,G是目前使用量最多的金属.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com