
【题目】下列条件下铁制品最容易生锈的是
A. 全浸在纯水中B. 半浸在盐水中
C. 露置在干燥空气中D. 半浸在有机溶剂溶液中
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】钴的氧化物广泛应用于磁性材料及超导材料等领域。一种利用含钴废料(主要成分Co2O3,含少量Al2O3、MgO、SiO2等)制备Co2O3的工艺流程如下图所示。
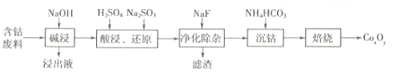
(1)“浸出液”的主要成分是________(写化学式)。
(2)“酸浸,还原”过程中溶解Co2O3的离子方程式为______________。稀硫酸和Na2SO3也可用盐酸替代,工业生产中不用盐酸的理由是_____________。
(3)NaF的作用是____________。
(4)“沉钴”时生成CoCO3的化学方程式为___________。检验CoCO3是否洗涤干净的操作方法是_______________。
(5)在空气中焙烧CoCO3生成CoxOy和CO2,测得充分煅烧后固体质量为4.82g,CO2的体积为1.344L(标准状况),则CoxOy的化学式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)系统命名法命名下列物质
①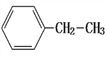 ________;②
________;②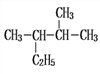 ________;③
________;③![]() ________;
________;
(2)C6H5CH2OH的类别是________,所含官能团的电子式为_________。
(3)已知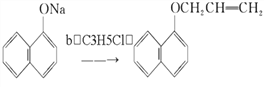 ,试剂b的结构简式为______,b中官能团的名称是________。
,试剂b的结构简式为______,b中官能团的名称是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验事实得出的相应结论不正确的是
选项 | 事实 | 结论 |
A | 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间缩短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
B | 向2.0 mL浓度均为0.1 mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01 mol·L-1AgNO3溶液,振荡,沉淀呈黄色 | Ksp:AgCl>AgI |
C | 2NO2(g) | 加压平衡向着气体颜色加深的方向移动 |
D | 将MgCl2溶液蒸干后灼烧,得到MgO固体 | 蒸干的过程中水解生成的HCl挥发,水解进一步促进生成Mg(OH)2,灼烧后产生MgO |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是 ( )
A. 氢氧化钠溶液与稀醋酸反应:OH-+H+=H2O
B. 碳酸钙与足量稀硝酸反应:CaCO3+2H+=Ca2++H2O+CO2↑
C. 氯化铝溶液与过量氨水反应:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
D. 钠与水反应:Na+2H2O=Na++2OH-+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 0.1mol/LpH为4的NaHB溶液中:c (HB-)>c(H2B)>c(B2-)
B. 如图表示25℃时,用0.1mol·L-1盐酸滴定20mL0.1mol·L-1NaOH溶液时,溶液的pH随加入酸体积的变化

C. 在pH=2的NaHSO4溶液中c(H+)=c(OH-)+ c(SO42-)
D. pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如图所示,分别滴加NaOH溶液(c=0.1mol·L-1)至pH=3,消耗NaOH溶液的体积为Vx、Vy,则x为强酸,y为弱酸且Vx>Vy

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组研究二价铁的还原性,设计如下实验。
序号 | 实验方案 | 现象 |
Ⅰ |
| 现象a:生成白色沉淀,3 min后沉淀基本变为红褐色 |
Ⅱ |
| 现象b:生成白色沉淀,3 min后沉淀颜色几乎不变 |
(1)实验所用的FeSO4溶液由Fe2(SO4)3溶液和足量铁粉反应制得,离子方程式是____。
(2)实验I中沉淀变为红褐色的化学方程式是________。
(3)关于实验II中白色沉淀的组成,小组同学展开研究。
① 已知Fe(HCO3)2在水中不存在。对沉淀组成作出如下假设,请补充完整。
假设a:依据NaHCO3溶液显_______性,推测白色沉淀可能为Fe(OH)2;
假设b:白色沉淀可能为_______。
② 研究白色沉淀组成的实验如下:
i.取少量白色沉淀,充分洗涤,向其中加入稀硫酸,沉淀完全溶解,产生无色气泡;
ii.向所得溶液中滴入KSCN试剂,溶液几乎不变红;
iii.向ii溶液中再滴入少量H2O2,溶液立即变为红色。
由此说明,白色沉淀中一定含有_________离子。
③ 研究过程中发现白色沉淀在空气中久置,最终变为红褐色。则该沉淀比实验I中所得的Fe(OH)2______(填“难”或“易”)于被空气氧化。
(4)对比实验I,研究酸碱性对二价铁还原性的影响,设计实验III:
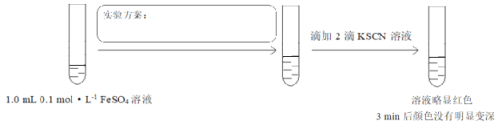
将实验方案补充完整______。
(5)据以上实验,为避免二价铁被空气氧化,可采取的措施是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向200 mL 某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2 ,充分反应后,得到Na2CO3和NaHCO3的混合溶液。向上述所得溶液中,逐滴滴加2 mol∕L的盐酸,所得气体的体积与所加盐酸的体积关系如图所示:
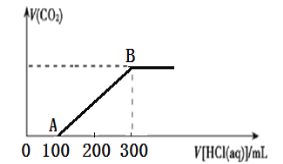
(1)OA段、AB段发生反应的离子方程式:_____________________、___________________。
(2)B点时,反应所得溶液中溶质的物质的量浓度是_____________。
(3)原NaOH溶液的物质的量浓度是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com