
| A. | 不可能是分解反应 | B. | 一定是置换反应 | ||
| C. | 可能是化合反应 | D. | 一定不是复分解反应 |
分析 A.分解反应可能生成单质、化合物;
B.CO与氧化铜反应生成Cu和二氧化碳;
C.化合反应的生成物只有一种;
D.复分解反应的产物为化合物.
解答 解:A.分解反应可能生成单质、化合物,如过氧化氢分解生成水、氧气,故A错误;
B.CO与氧化铜反应生成Cu和二氧化碳,该反应不是置换反应,故B错误;
C.化合反应的生成物只有一种,则一定不是化合反应,故C错误;
D.复分解反应的产物为化合物,则有单质、化合物生成的反应一定不是复分解反应,故D正确;
故选D.
点评 本题考查物质的组成和性质,为高频考点,把握常见的反应及物质类别为解答的关键,侧重分析与应用能力的考查,注意结合实例分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某反应由两步反应 A、B、C 构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).回答下列问题
某反应由两步反应 A、B、C 构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
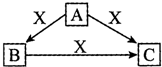 A、B、C、X均为中学化学常见的物质,一定条件下,它们有如下转化关系(部分产物已略去),下列说法错误的是( )
A、B、C、X均为中学化学常见的物质,一定条件下,它们有如下转化关系(部分产物已略去),下列说法错误的是( )| A. | 若X为Cl2,则C可能为FeCl3 | |
| B. | 若X为KOH溶液,则A可能为AlCl3溶液 | |
| C. | 若X为Fe,则A可能为HNO3 | |
| D. | 若A、B、C均为焰色反应呈黄色的化合物,则X可能为CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{3}{10}$ | B. | $\frac{b}{2a+2b}$ | C. | $\frac{3}{16}$ | D. | $\frac{5}{16}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数的周期性变化 | |
| B. | 原子半径呈现从大到小的周期性变化 | |
| C. | 元素化合价呈现周期性的变化 | |
| D. | 元素的金属性和非金属性呈现周期性的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150ml 1mol/L氯化钠溶液 | B. | 150ml 3mol/L氯化钾溶液 | ||
| C. | 75ml 2mol/L氯化铵溶液 | D. | 50ml 1mol/L氯化铜溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com