
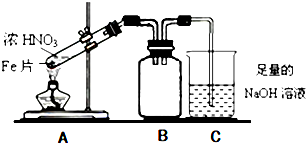
| A. | 分别加入Na0H溶液并加热,鉴别地沟油(餐饮废弃油)和矿物油(汽油、煤油等) | |
| B. | 为检验酸性溶液中的Cl-和SO42-,先加硝酸银溶液,滤去沉淀后加硝酸钡溶液 | |
| C. | 为探究温度对化学反应速率的影响时,先将硫代硫酸钠与硫酸两种溶液混合后再用水浴加热 | |
| D. | 往含有FeBr2和FeI2的混合溶液中通足量的氯气,然后把溶液蒸干、灼烧,得到FeCl3固体 |
分析 A.地沟油(餐饮废弃油)的成分为油脂,可发生水解反应,而矿物油的成分为烃类物质;
B.先加硝酸银溶液,二者均生成沉淀;
C.用水浴加热,温度恒定;
D.混合溶液中通足量的氯气,最终为氯化铁溶液,加热促进铁离子水解.
解答 解:A.地沟油(餐饮废弃油)的成分为油脂,可发生水解反应,而矿物油的成分为烃类物质,油脂与NaOH反应,而烃不能,可鉴别,故A正确;
B.先加硝酸银溶液,二者均生成沉淀,不能检验,故B错误;
C.用水浴加热,温度恒定,不能探究温度对反应速率的影响,故C错误;
D.混合溶液中通足量的氯气,最终为氯化铁溶液,加热促进铁离子水解,则把溶液蒸干、灼烧,得到氧化铁固体,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、离子检验、盐类水解等为解答的关键,侧重分析与实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 溶质 | NaF | Na2CO3 | NaClO | NaHCO3 |
| pH | 7.5 | 11.6 | 9.7 | 8.3 |
| A. | 在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF | |
| B. | 若将CO2通入0.1mol/L Na2CO3溶液至溶液中性,则溶液中:2c(CO32-)+c(HCO3-)=0.1mol/L | |
| C. | 等体积等物质的量浓度的NaClO溶液与NaF溶液中离子总数大小:N前<N后 | |
| D. | 向Na2CO3溶液中通入少量的HF气体,化学反应方程式为:Na2CO3+2HF═CO2+H2O+2NaF |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学平衡常数的大小只与温度有关,与浓度、压强、催化剂无关 | |
| B. | 相同温度时,Ka(HCN)<Ka(CH3COOH),说明物质的量浓度相同时,氢氰酸的酸性比醋酸弱 | |
| C. | 向氯化钡溶液中加入同浓度的碳酸钠和硫酸钠溶液,先产生BaSO4沉淀,则Ksp(BaSO4)>Ksp(BaCO3) | |
| D. | 当温度升高时,Ka(CH3COOH)变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
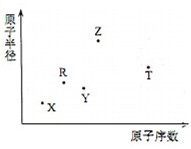 短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.R原子最外层电子数是电子层数的2倍.Y与Z能形成Z2Y、Z2Y2型离子化合物.Z与T形成的化合物Z2T能破坏水的电离平衡.下列推断正确的是( )
短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.R原子最外层电子数是电子层数的2倍.Y与Z能形成Z2Y、Z2Y2型离子化合物.Z与T形成的化合物Z2T能破坏水的电离平衡.下列推断正确的是( )| A. | 原子半径和离子半径均满足:Y<Z | |
| B. | 氢化物的沸点不一定是:Y>R | |
| C. | 最高价氧化物对应水化物的酸性:T<R | |
| D. | 由X、R、Y、Z四种元素组成的化合物水溶液一定显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
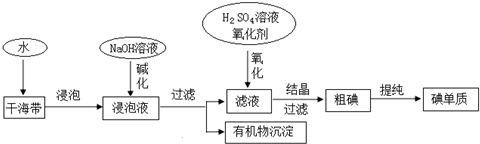
| A. | 因海水中蕴藏着极其丰富的碘元素,所以工业上也可以直接用海水来提取碘元素 | |
| B. | 碱化操作时,加入NaOH溶液的原因是在碱性溶液中,可溶性有机质可形成沉淀 | |
| C. | 在实验室进行氧化操作时,加入的氧化剂可以是新制氯水、双氧水等 | |
| D. | 在实验室进行过滤操作时,需要用到玻璃仪器有玻璃棒、烧杯、漏斗 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水、液氯都含有氯气分子,均为混合物 | |
| B. | SiO2与Al2O3都既可以与酸又可以与碱反应,故都是两性氧化物 | |
| C. | 胶体与溶液的分散质粒子均可以通过滤纸 | |
| D. | 氢氟酸可用于刻蚀玻璃,是利用SiO2酸性氧化物的性质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com