
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向FeBr2溶液中通入少量Cl2 | 溶液由浅绿色变为黄色 | 氧化性:Cl2>Br2 |
| B | 向Na2SO3溶液中滴加盐酸 | 有气体产生 | 非金属性:Cl>S |
| C | 向pH=3的HA和HB溶液中分别加水稀释至100倍 | pH(HA)>pH(HB) | 酸性:HA>HB |
| D | 向重晶石中加入饱和碳酸钠溶液 | 重晶石逐渐溶解 | 溶度积:Ksp(BaCO3)<Ksp(BaSO4) |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氯气先氧化亚铁离子;
B.发生强酸制取弱酸的反应,可知酸性为盐酸大于亚硫酸;
C.等pH的酸,稀释相同倍数时酸性强的变化大;
D.加入饱和碳酸钠溶液,Qc(BaCO3)>Ksp(BaCO3),为沉淀的生成.
解答 解:A.少量氯气先氧化亚铁离子,溶液由浅绿色变为黄色,结论不合理,故A错误;
B.发生强酸制取弱酸的反应,可知酸性为盐酸大于亚硫酸,不能比较Cl、S的非金属性,故B错误;
C.等pH的酸,稀释相同倍数时酸性强的变化大,则由pH(HA)>pH(HB)可知,酸性:HA>HB,故C正确;
D.加入饱和碳酸钠溶液,Qc(BaCO3)>Ksp(BaCO3),为沉淀的生成,不能比较Ksp(BaCO3)、Ksp(BaSO4),硫酸钡更难溶,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握氧化还原反应、酸的稀释、沉淀生成、非金属性比较、实验技能为解本题关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:选择题
| A. | c(H+)/c(OH?)=1的无色溶液中:Fe3+、NH4+、Cl?、SO42? | |
| B. | 使甲基橙呈黄色的溶液中:Na+、ClO?、SO42?、I? | |
| C. | 0.1 mol•L-1NaAlO2溶液:H+、Na+、Cl-、SO42- | |
| D. | pH=12的溶液:K+、Na+、CH3COO-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铜电极电解CuSO4溶液 阳极:Cu-2e-=Cu2+ | |
| B. | 电镀铜时(电解质溶液为CuSO4溶液) 阳极:Cu2++2e-=Cu | |
| C. | 电解熔融NaCl 阴极:Na++e-=Na | |
| D. | 电解NaOH溶液 阳极:4OH--4e-=2H2O+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
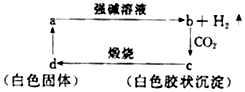
| A. | a在与强碱溶液的反应中氧化剂是强碱 | |
| B. | 向b中滴加适量盐酸可得到c | |
| C. | c不一定是两性物质 | |
| D. | d一定能和氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
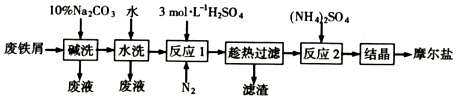
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 硅、锗都位于金属与非金属的交界处,都可以做半导体材料 | |
| B. | 氢化物的沸点:H2O>NH3>HF | |
| C. | 同主族元素从上到下,单质的熔点逐渐降低 | |
| D. | P的非金属性强于Si,H3PO4比H2SiO3的酸性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
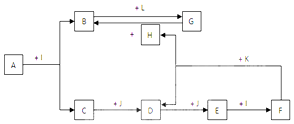
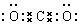 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 序号 | 温度 | 0min | 10min | 20min | 30min | 40min | 50min |
| 1 | 820℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 |
| 2 | 820℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com