
【题目】二氧化硫的催化氧化是工业上生产硫酸的主要反应,反应如下:
I:2SO2(g)+O2(g)![]() 2SO3(g) △H1=-197.7kJ·mol-1 K1(浓度平衡常数)
2SO3(g) △H1=-197.7kJ·mol-1 K1(浓度平衡常数)
为研究该反应,某同学设计了以下三种已装固体V2O3催化剂的密闭容器装置

(1)在初始体积与温度相同的条件下,甲、乙、丙中均按2 mol SO2、1molO2投料,达平衡时,三个容器中SO2的转化率从大到小的顺序为___________(用“甲、乙、丙”表示)。
(2)在容器丙中,0.1MPa条件下,在不同温度或不同投料方式下研究上述反应得到数据如下表:

①表中:a=___________;b=___________。
②已知用平衡分压(分压=总压×物质的量分数)代替平衡浓度计算,得到的平衡常数即为压强平衡常数,则Kp1=___________;Kp1___________Kp2(填“>”、“<”或“=”)。
③若按0.4 mol SO2、0.4molO2、0.4 mol SO3进行投料,则反应开始时v正(SO2)_______v逆(SO2)(填“>”、“<”或“=”)。
(3)将上述固体催化剂V2O5换成NO2气体同样可以对该反应起到催化作用,此催化过程如下:
Ⅱ:SO2(g)+NO2(g)![]() SO3(g)+NO(g) △H2 K2(浓度平衡常数)
SO3(g)+NO(g) △H2 K2(浓度平衡常数)
Ⅲ:2NO(g)+O2(g)![]() 2NO2(g) △H3=-114.1kJ·mol-1 K3(浓度平衡常数)
2NO2(g) △H3=-114.1kJ·mol-1 K3(浓度平衡常数)
△H2=___________;K3=___________(用含有K1、K2的表达式表示)。
【答案】丙>甲>乙 118.62kJ 40% 135MPa-1 > > -41.8 kJ·mol-1 ![]()
【解析】
(1)在初始体积与温度相同的条件下,甲为恒温恒容、乙为绝热恒容、丙为恒温恒压,均按2 mol SO2、1molO2投料,与甲相比,乙中随着反应的进行,温度升高,平衡逆向移动,丙中随着反应的进行,容器的体积逐渐减小,相当于甲平衡后增大压强,平衡正向移动,据此分析判断;
(2) ①根据表格数据,A组起始时充入2 mol SO2、1molO2,平衡转化率为60%,结合2SO2(g)+ O2(g) ![]() 2SO3(g)△H1=-197.7kJ·mol-1,计算平衡时放出的热量a;B组起始时充入2mol SO3,与A组等效,据此判断平衡时三氧化硫的转化率b;
2SO3(g)△H1=-197.7kJ·mol-1,计算平衡时放出的热量a;B组起始时充入2mol SO3,与A组等效,据此判断平衡时三氧化硫的转化率b;
②根据三段式计算平衡时气体的总物质的量,再计算三种物质的物质的量分数,结合压强平衡常数的含义计算K;该反应为放热反应,根据温度对平衡的影响分析判断;
③按0.4 mol SO2、0.4molO2、0.4 mol SO3进行投料,相当于按0.8 mol SO2、0.6molO2进行投料,与A组等效,结合A组平衡时的各成分的物质的量判断反应的方向;
(3) 根据盖斯定律,![]() ×(I-III)得II,I-II×2得III,据此分析解答。
×(I-III)得II,I-II×2得III,据此分析解答。
(1)在初始体积与温度相同的条件下,甲为恒温恒容、乙为绝热恒容、丙为恒温恒压,均按2 mol SO2、1molO2投料,与甲相比,乙中随着反应的进行,温度升高,平衡逆向移动,SO2的转化率减小;与甲相比,丙中随着反应的进行,容器的体积逐渐减小,相当于甲平衡后增大压强,平衡正向移动,SO2的转化率增大,因此三个容器中SO2的转化率从大到小的顺序为丙>甲>乙,故答案为:丙>甲>乙;
(2) ①根据表格数据,A组起始时充入2 mol SO2、1molO2,平衡转化率为60%,结合2SO2(g)+ O2(g) ![]() 2SO3(g)△H1=-197.7kJ·mol-1,平衡时放出的热量a=197.7kJ×60%=118.62kJ,B组起始时充入2mol SO3,与A组等效,则平衡时三氧化硫的转化率b=1-60%=40%,故答案为:118.62kJ;40%;
2SO3(g)△H1=-197.7kJ·mol-1,平衡时放出的热量a=197.7kJ×60%=118.62kJ,B组起始时充入2mol SO3,与A组等效,则平衡时三氧化硫的转化率b=1-60%=40%,故答案为:118.62kJ;40%;
②A组: 2SO2(g)+ O2(g) ![]() 2SO3(g)
2SO3(g)
起始(mol) 2 1 0
反应(mol) 1.2 0.6 1.2
平衡(mol) 0.8 0.4 1.2
平衡时气体的总物质的量=0.8 mol +0.4 mol +1.2 mol =2.4mol,其中SO2占![]() =
=![]() ,O2占
,O2占![]() =
=![]() ,SO3占
,SO3占![]() =
=![]() ,则Kp1=
,则Kp1=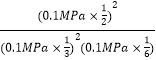 =135MPa-1;该反应为放热反应,升高温度,平衡逆向移动,平衡常数减小,Kp1>Kp2,故答案为:135MPa-1;>;
=135MPa-1;该反应为放热反应,升高温度,平衡逆向移动,平衡常数减小,Kp1>Kp2,故答案为:135MPa-1;>;
③A组平衡时n(SO2): n(O2) : n(SO3)=0.8:0.4:1.2=2:1:3。该反应为气体体积减小的反应,若按0.4 mol SO2、0.4molO2、0.4 mol SO3进行投料,相当于按0.8 mol SO2、0.6molO2进行投料,与A组等效,n(SO2): n(O2) : n(SO3)=0.4:0.2:0.4=2:1:2
(3) I:2SO2(g)+O2(g)![]() 2SO3(g) △H1=-197.7kJ·mol-1 K1,
2SO3(g) △H1=-197.7kJ·mol-1 K1,
Ⅱ:SO2(g)+NO2(g)![]() SO3(g)+NO(g) △H2 K2,
SO3(g)+NO(g) △H2 K2,
Ⅲ:2NO(g)+O2(g)![]() 2NO2(g) △H3=-114.1kJ·mol-1 K3,
2NO2(g) △H3=-114.1kJ·mol-1 K3,
根据盖斯定律,将I-II得:2SO2(g)+2NO2(g)![]() 2SO3(g)+2NO(g) 2△H2=(-197.7kJ·mol-1)-(-114.1kJ·mol-1)= -83.6 kJ·mol-1,则△H2= -41.8 kJ·mol-1;
2SO3(g)+2NO(g) 2△H2=(-197.7kJ·mol-1)-(-114.1kJ·mol-1)= -83.6 kJ·mol-1,则△H2= -41.8 kJ·mol-1;
根据盖斯定律,将I-II×2得2NO(g)+O2(g)![]() 2NO2(g),则K3=
2NO2(g),则K3=![]() ,
,
故答案为:-41.8 kJ·mol-1;![]() 。
。


科目:高中化学 来源: 题型:
【题目】将SO2气体分别通入下列四种溶液中,有关现象及结论的说法正确的是
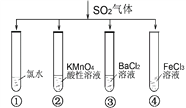
A. 试管①中有淡黄色沉淀生成,说明SO2有氧化性
B. 试管②中溶液褪色,说明SO2有漂白性
C. 试管③中能产生白色沉淀,说明SO2有酸性
D. 试管④中溶液颜色变浅,说明SO2有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某芳香烃的分子式为C9H12,已知苯环上的一氯取代物只有两种,下列说法中正确的是
A. 该有机物不能发生取代反应,但能发生加成反应
B. 该有机物不能使酸性高锰酸钾溶液褪色,但能使溴水褪色
C. 该有机物分子中的所有原子可能在同一平面上
D. 该有机物的一氯取代物最多有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列几组物质,请将序号填入下列空格内:
A、C60和石墨 B、35Cl和37Cl C、![]() 和
和![]()
D、乙醇和甘油 E、CH2=CH-COOH和油酸(C17H33COOH)
①互为同位素的是______________; ②互为同系物的是_________________;
③互为同素异形体的是__________; ④互为同分异构体的是_____________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用VSEPR推断分子或离子的空间构型。
PO![]() __________;CS2____________;AlBr3(共价分子)__________。
__________;CS2____________;AlBr3(共价分子)__________。
(2)有两种活性反应中间体粒子,它们的粒子中均含有1个碳原子和3个氢原子。请依据下面给出的这两种粒子的球棍模型,写出相应的化学式:
 ______________;
______________; ______________。
______________。
(3)按要求写出第二周期非金属元素构成的中性分子的化学式。
平面三角形分子________,三角锥形分子________,四面体形分子________。
(4)为了解释和预测分子的空间构型,科学家在归纳了许多已知的分子空间构型的基础上,提出了一种十分简单的理论模型——价层电子对互斥模型。这种模型把分子分成两类:一类是____________________;另一类是____________________。
BF3和NF3都是四个原子的分子,BF3的中心原子是________,NF3的中心原子是________;BF3分子的立体构型是平面三角形而NF3分子的立体构型是三角锥形的原因是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某钙钛型复合氧化物如图所示,以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应。
(1)用A,B,O表示这类特殊晶体的化学式:____________________。
(2)已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3(x<0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁—铁磁、铁磁—顺磁及金属—半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为__________。
(3)Mn的外围电子排布式为______________。
(4)下列有关说法正确的是________。

A.镧、锰、氧分别位于周期表f、d、p区
B.氧的第一电离能比氮的第一电离能大
C.锰的电负性为1.59,Cr的电负性为1.66,说明锰的金属性比铬强
D.铬的堆积方式与钾相同,则其堆积方式如图所示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代循环经济要求综合考虑环境污染和经济效益。高纯氧化铁可作现代电子工业的材料,如图是用硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原料制备高纯氧化铁(软磁α-Fe2O3)的生产流程示意图,下列说法错误的是( )

A. 步骤I中过滤所得滤渣的主要成分是SiO2
B. 步擦Ⅱ中加入铁粉的目的是将Fe3+还原为Fe2+
C. 步骤Ⅲ中可选用稀硝酸调节溶液的pH
D. 从滤液C中回收的主要物质可作氮肥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家一直致力于“人工固氮”的方法研究.用N2和H2合成NH3的能量变化如图所示。

(1)合成氨反应的热化学方程式_________________________,已知E2=212.4kJ/mol,则该反应正反应的活化能是______。
(2)反应体系中加入催化剂,反应速率______,E2的变化是______。(填“增大”、“减小”或“不变”)
(3)工业上常采用高温高压,使用催化剂的方法改变该反应的反应速率,在甲乙两个体积均为2L固定容积的密闭容器中,分别充入1molN2、3molH2和1molN2、3molH2、1molHe,反应速率甲__乙(填大于、小于或等于)。
(4)该反应的△S______0,(填大于、小于或等于),理论上在______条件下可以自发。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com