
£Ø9·Ö£©ŅŃÖŖ£ŗ2SO2(g)+O2(g) 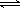 2SO3(g)£»”÷H=£196 kJ/mo1£¬850KŹ±£¬ŌŚ2L¹Ģ¶ØČŻ»żµÄĆܱÕČŻĘ÷ÖŠ³äČė2mol SO2ŗĶ2mol O2£¬10·ÖÖÓŗó“ļµ½Ę½ŗā£¬SO2ÅضČŗĶŹ±¼ä¹ŲĻµČēĶ¼”£
2SO3(g)£»”÷H=£196 kJ/mo1£¬850KŹ±£¬ŌŚ2L¹Ģ¶ØČŻ»żµÄĆܱÕČŻĘ÷ÖŠ³äČė2mol SO2ŗĶ2mol O2£¬10·ÖÖÓŗó“ļµ½Ę½ŗā£¬SO2ÅضČŗĶŹ±¼ä¹ŲĻµČēĶ¼”£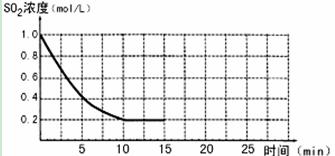
»Ų“šĻĀĮŠĪŹĢā
£Ø1£©Ē°10·ÖÖÓÄŚO2µÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ mol/(L”¤min)
£Ø2£©Ę½ŗāŹ±£¬02µÄ×Ŗ»ÆĀŹĪŖ £¬“ĖŹ±·“Ó¦¹²·ÅČČ kJ”£
£Ø3£©Čō15·ÖÖÓŹ±Ī¬³ÖĪĀ¶Č²»±ä£¬Ń¹ĖõČŻĘ÷Ģå»ż£¬Ź¹ĘäĢå»ż±äĪŖ1L£¬¼ŁÉčŌŚ20·ÖÖÓŹ±“ļµ½ŠĀĘ½ŗā£¬“ĖŹ±c£ØO2£©=1£®15 mol/L£¬ĒėŌŚĶ¼ÉĻ»³ö15-25·ÖÖÓSO2µÄÅØ¶Č±ä»ÆĒśĻß”£
£Ø1£©0£®04£Ø2·Ö£©
£Ø2£©40% (2·Ö) 156£®8 (2·Ö)
£Ø3£©(3·Ö)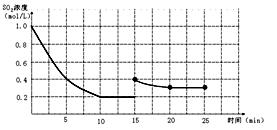
½āĪöŹŌĢā·ÖĪö£ŗ£Ø1£©Ē°10·ÖÖÓÄŚO2µÄĘ½¾ł·“Ó¦ĖŁĀŹ=1/2V(SO2)=1/2(1-0£®2)/10=0£®04mol/(L”¤min)”££Ø2£© Ņ»¶ØĪĀ¶ČĻĀ£¬½«0£®4molSO2ŗĶ0£®2molO2·ÅČė¹Ģ¶ØČŻ»żĪŖ2LµÄĆܱÕČŻĘ÷ÖŠ£¬·¢Éś·“Ó¦2SO2£Øg£©+O2£Øg£©?2SO3£Øg£©”÷H=-196£®6kJ/mol£¬·“Ó¦ÖŠSO3µÄĪļÖŹµÄĮæÅØ¶ČµÄ±ä»ÆĒéæöČēĶ¼·ÖĪöµĆµ½Ę½ŗāŹ±C£ØSO3£©=0£®1mol/L£¬Ę½ŗāÉś³ÉČżŃõ»ÆĮņĪļÖŹµÄĮæ=0£®1mol/L”Į2L=0£®2mol£»ŅĄ¾Ż»ÆŃ§Ę½ŗāČż¶ĪŹ½ĮŠŹ½¼ĘĖć
2SO2£Øg£©+O2£Øg£©?2SO3£Øg£©”÷H=-196£®6kJ/mol£¬
ĘšŹ¼Įæ£Ømol/L£© 1 1 0
±ä»ÆĮæ£Ømol/L£© 08 0£®4 0£®8
Ę½ŗāĮæ£Ømol/L£© 0£®2 0£®6 0£®8
¹ŹŃõĘųµÄ×Ŗ»ÆĀŹ=0£®4/1=40%”£Q=0£®8*196£®6=156£®8kJ”£
£Ø2£©ŌŚµŚ15·ÖÖÓÄ©½«ČŻĘ÷µÄĢå»żĖõŠ”Ņ»°ėŗ󣬓ĖŹ±ø÷ĪļÖŹµÄĮæÅضČŌö¼ÓŅ»±¶£¬Ń¹ĒæŌö“óĘ½ŗāÕżĻņ½ųŠŠ£¬ŌŚ20·ÖÖÓŹ±“ļµ½ŠĀĘ½ŗā£¬“ĖŹ±c£ØO2£©=1£®15 mol/L£¬
2SO2£Øg£©+O2£Øg£©?2SO3£Øg£©”÷H=-196£®6kJ/mol£¬
ĘšŹ¼Įæ£Ømol/L£© 0£®4 1£®2 1£®6
±ä»ÆĮæ£Ømol/L£© 0£®1 0£®05 0£®1
Ę½ŗāĮæ£Ømol/L£© 0£®3 1£®15 1£®7
ÖÕµć¶žŃõ»ÆĮņµÄÅضČĪŖ0£®3 mol/L£¬ĒśĻß±ä»ÆĀżĀżĻņĻĀ£¬20·ÖÖÓÖ®ŗóÅØ¶Č²»±ä”£¹ŹĶ¼ŠĪČēĻĀ£ŗ
æ¼µć£ŗ±¾Ģāæ¼²éĮĖ»Æѧ·“Ó¦ĖŁĀŹµÄ¶ØĮæ±ķŹ¾·½·Ø”¢»ÆŃ§Ę½ŗā³£Źż”¢»ÆŃ§Ę½ŗāµÄÓ°ĻģŅņĖŲµČÖŖŹ¶µć”£


 ŹĄ¼Ķ°ŁĶØÖ÷ĢåæĪĢĆŠ”ѧæĪŹ±Ķ¬²½“ļ±źĻµĮŠ“š°ø
ŹĄ¼Ķ°ŁĶØÖ÷ĢåæĪĢĆŠ”ѧæĪŹ±Ķ¬²½“ļ±źĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
ijĪĀ¶ČŹ±£¬ŌŚŅ»øöČŻ»żĪŖ2 LµÄĆܱÕČŻĘ÷ÖŠ£¬X”¢Y”¢Z£¬ČżÖÖĪļÖŹµÄĪļÖŹµÄĮæĖꏱ¼äµÄ±ä»ÆĒśĻßČēĶ¼ĖłŹ¾”£øł¾ŻĶ¼ÖŠŹż¾Ż£¬ŹŌĢīŠ“ĻĀĮŠæÕ°×£ŗ
£Ø1£©øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ______________£»
£Ø2£©·“Ó¦æŖŹ¼ÖĮ2 min£¬ÓĆĘųĢåZ±ķŹ¾µÄ·“Ó¦ĖŁĀŹĪŖ_____£»
£Ø3£©ČōX”¢Y”¢Z¾łĪŖĘųĢ壬·“Ó¦“ļµ½Ę½ŗāŹ±£ŗ
¢ŁŃ¹ĒæŹĒæŖŹ¼Ź±µÄ________±¶£»
¢ŚČō“ĖŹ±½«ČŻĘ÷µÄĢå»żĖõŠ”ĪŖŌĄ“µÄ 0.5±¶£¬“ļµ½Ę½ŗāŹ±£¬ČŻĘ÷ÄŚĪĀ¶Č½«½µµĶ(ČŻĘ÷²»ÓėĶā½ē½ųŠŠČČ½»»»)£¬ŌņøĆ·“Ó¦µÄÕż·“Ó¦ĪŖ________·“Ó¦(Ģī”°·ÅČČ”±»ņ”°ĪüČČ”±)”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
¢ń£®æĪ±¾ÖŠĶعżĻņ²ŻĖį£ØH2C2O4£©ČÜŅŗÖŠµĪ¼ÓÓĆĮņĖįĖį»ÆøßĆĢĖį¼ŲÖŠŃŠ¾æÅØ¶Č¶Ō»Æѧ·“Ó¦ĖŁĀŹµÄÓ°Ļģ£¬ĒėÄ抓³öøĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ £¬øĆ·“Ó¦²»ŠčŹ¹ÓĆÖøŹ¾¼ĮµÄŌŅņŹĒ £»
¢ņ£®Ä³Ķ¬Ń§øł¾ŻæĪ±¾Ķā½ēĢõ¼ž¶Ō»Æѧ·“Ó¦ĖŁĀŹµÄÓ°ĻģŌĄķ£¬Éč¼ĘĮĖĮņ“śĮņĖįÄĘÓėĮņĖį·“Ó¦ÓŠ¹ŲŹµŃ飬ŹµŃé¹ż³ĢµÄŹż¾Ż¼ĒĀ¼ČēĻĀ£Ø¼ū±ķøń£©£¬Ēė½įŗĻ±ķÖŠŠÅĻ¢£¬»Ų“šÓŠ¹ŲĪŹĢā£ŗ
| ŹµŃé ŠņŗÅ | ·“Ó¦ĪĀ¶Č £Ø”ę£© | ²Ī¼Ó·“Ó¦µÄĪļÖŹ | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/mL | c/mol?L-1 | V/mL | c/mol?L-1 | V/mL | ||
| A | 20 | 10 | 0£®1 | 10 | 0£®1 | 0 |
| B | 20 | 5 | 0£®1 | 10 | 0£®1 | 5 |
| C | 20 | 10 | 0£®1 | 5 | 0£®1 | 5 |
| D | 40 | 5 | 0£®1 | 10 | 0£®1 | 5 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
I£®Éč·“Ó¦¢ŁFe(s)+CO2(g)  FeO(s)+CO(g)µÄĘ½ŗā³£ŹżĪŖK1”£
FeO(s)+CO(g)µÄĘ½ŗā³£ŹżĪŖK1”£
·“Ó¦¢ŚFe(s)+H2O(g)  FeO(s)+H2(g)µÄĘ½ŗā³£ŹżĪŖK2£¬
FeO(s)+H2(g)µÄĘ½ŗā³£ŹżĪŖK2£¬
ŌŚ²»Ķ¬ĪĀ¶ČĻĀ£¬K1”¢K2µÄÖµČēĻĀ£ŗ
| T(K) | K1 | K2 |
| 973 | 1.47 | 2.36 |
| 1173 | 2.15 | 1.67 |
 CO(g)+H2O(g)£¬ÕāŹĒŅ»øö (Ģī”°Īü”±»ņ”°·Å”±)ČČ·“Ó¦£¬ŅŖŹ¹Ę½ŗā¢ŪĻņÓŅŅĘ¶Æ£¬æɲÉČ”µÄ“ėŹ©ÓŠ (ĢīŠņŗÅ)”£
CO(g)+H2O(g)£¬ÕāŹĒŅ»øö (Ģī”°Īü”±»ņ”°·Å”±)ČČ·“Ó¦£¬ŅŖŹ¹Ę½ŗā¢ŪĻņÓŅŅĘ¶Æ£¬æɲÉČ”µÄ“ėŹ©ÓŠ (ĢīŠņŗÅ)”£ FeO(s)+CO(g)ŌŚĪĀ¶ČT1ĻĀ½ųŠŠ£»Fe(s)+H2O(g)
FeO(s)+CO(g)ŌŚĪĀ¶ČT1ĻĀ½ųŠŠ£»Fe(s)+H2O(g)  FeO(s)+H2(g)ŌŚĪĀ¶ČT2ĻĀ½ųŠŠ£¬ŅŃÖŖT1>T2£¬ĒŅc(CO2)>c(H2O)(ĘäĖūĢõ¼ž¾łĻąĶ¬)£¬ŌņĮ½Õߵķ“Ó¦ĖŁĀŹ (ĢīŠņŗÅ)
FeO(s)+H2(g)ŌŚĪĀ¶ČT2ĻĀ½ųŠŠ£¬ŅŃÖŖT1>T2£¬ĒŅc(CO2)>c(H2O)(ĘäĖūĢõ¼ž¾łĻąĶ¬)£¬ŌņĮ½Õߵķ“Ó¦ĖŁĀŹ (ĢīŠņŗÅ)
| »ÆѧŹ½ | µēĄėĘ½ŗā³£Źż(25”ę) |
| HCN | K£½4.9”Į10£10 |
| CH3COOH | K£½1.8”Į10£5 |
| H2CO3 | K1£½4.3”Į10£7”¢K2£½5.6”Į10£11 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
ŅŃÖŖ·“Ó¦A£Øg£©+B(g) C(g)+D(g)”÷H£¼0»Ų“šĻĀĮŠĪŹĢā£ŗ
C(g)+D(g)”÷H£¼0»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©øĆ·“Ó¦ŹĒ________·“Ó¦£ØĢī”°ĪüČČ”±»ņ”°·ÅČČ”±£©
£Ø2£©µ±·“Ó¦“ļµ½Ę½ŗāŹ±£¬ÉżøßĪĀ¶Č£¬AµÄ×Ŗ»ÆĀŹ________£ØĢī”°Ōö“ó”±”°¼õŠ””±»ņ”°²»±ä”±£©”£ŌŅņŹĒ________________________________________”£
£Ø3£©·“Ó¦ĢåĻµÖŠ¼ÓČė“߻ƼĮ£¬¶Ō·“Ó¦ČČŹĒ·ńÓŠÓ°Ļģ£æ________£»ŌŅņŹĒ_________________________________________________”£
£Ø4£©·“Ó¦ĢåĻµÖŠ¼ÓČė“߻ƼĮ£¬·“Ó¦ĖŁĀŹ________£ØĢī”°Ōö“ó”±”°¼õŠ””±»ņ”°²»±ä”±£©£»·“Ó¦µÄ»ī»ÆÄÜ________£ØĢī”°Ōö“ó”±”°¼õŠ””±»ņ”°²»±ä”±£©”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
ijŠ©½šŹō¼°½šŹōŃõ»ÆĪļ¶ŌH2O2µÄ·Ö½ā·“Ó¦¾ßÓŠ“ß»Æ×÷ÓĆ£¬Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ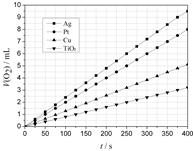
£Ø1£©ŅŃÖŖ£ŗ2H2O2(aq) =" 2" H2O (l) + O2(g) µÄ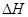 < 0, ŌņøĆ·“Ó¦µÄÄę·“Ó¦ÄÜ·ń×Ō·¢½ųŠŠ£æ £ØĢī”°ÄÜ”±»ņ”°²»ÄÜ”±£©£¬ÅŠ¶ĻŅĄ¾ŻŹĒ ”£
< 0, ŌņøĆ·“Ó¦µÄÄę·“Ó¦ÄÜ·ń×Ō·¢½ųŠŠ£æ £ØĢī”°ÄÜ”±»ņ”°²»ÄÜ”±£©£¬ÅŠ¶ĻŅĄ¾ŻŹĒ ”£
£Ø2£©Ä³Ķ¬Ń§Ń”ÓĆAg”¢Pt”¢Cu”¢TiO2×÷ĪŖ“߻ƼĮ£¬ŌŚ25”ę Ź±£¬±£³ÖĘäĖüŹµŃéĢõ¼žĻąĶ¬£¬²āµĆÉś³ÉµÄO2Ģå»ż£ØV£©”£VÓė·Ö½āŹ±¼ä(t)µÄ¹ŲĻµČēĶ¼ĖłŹ¾£ØO2µÄĢå»żŅŃÕŪĖć³É±ź×¼×“æö£©£¬Ōņ£ŗŌŚ²»Ķ¬“߻ƼĮ“ęŌŚĻĀ£¬H2O2·Ö½ā·“Ó¦µÄ»ī»ÆÄÜ“óŠ”Ė³ŠņŹĒ Ea( ) > Ea( ) > Ea( ) > Ea( ) £ØĄØŗÅÄŚĢīŠ““߻ƼĮµÄ»ÆѧŹ½)½šŹōPt “ß»ÆĻĀ£¬H2O2·Ö½āµÄ·“Ó¦ĖŁĀŹv(O2) = mol”¤s-1
£Ø3£©ĪŖŃŠ¾æĪĀ¶Č¶ŌH2O2·Ö½āĖŁĀŹµÄÓ°Ļģ£Ø²»¼Ó“߻ƼĮ£©£¬æɽ«Ņ»¶ØÅضČŗĶĢå»żµÄH2O2ÖĆÓŚĆܱÕČŻĘ÷ÖŠ£¬ŌŚÄ³ĪĀ¶ČĻĀ£¬¾¹żŅ»¶ØµÄŹ±¼ät£¬²ā¶ØÉś³ÉO2µÄĢå»żV”£Č»ŗó±£³ÖĘäĖü³õŹ¼Ģõ¼ž²»±ä£¬øıäĪĀ¶ČT£¬ÖŲø“ÉĻŹöŹµŃ锣»ńµĆV(O2) ~ T¹ŲĻµĒśĻß”£ĻĀĮŠĒ÷ŹĘĶ¼×īæÉÄÜ·ūŗĻŹµ²āV(O2) ~ T¹ŲĻµĒśĻߵďĒ £¬ŌŅņŹĒ ”£
| A£® | B£® | C£® | D£® £Ø4£©ŅŌPtĪŖµē¼«µē½āH2O2Ņ²æɲśÉśŃõĘų£¬Š“³öH2O2Ė®ČÜŅŗµē½ā¹ż³ĢÖŠµÄµē¼«·“Ó¦Ź½£ØŅŃÖŖ£ŗH2O2µÄŃõ»ÆŠŌ¼°»¹ŌŠŌ¾ł±ČH2OĒ棩£ŗŅõ¼«£»Ńō¼« ”£ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
ŌŚĢå»żĪŖ10LµÄČŻĘ÷ÖŠ£¬ĶØČĖŅ»¶ØĮæµÄCOŗĶH2O£¬ŌŚ850”ꏱ·¢ÉśČēĻĀ·“Ó¦£ŗ
CO(g)Ź®H2O(g)  CO2(g)Ź®H2 (g) ”÷H<0 £¬ COŗĶH2OÅØ¶Č±ä»ÆČēĻĀĶ¼£¬
CO2(g)Ź®H2 (g) ”÷H<0 £¬ COŗĶH2OÅØ¶Č±ä»ÆČēĻĀĶ¼£¬
£Ø1) 3min”Ŗ4minÖ®¼ä·“Ó¦“¦ÓŚ____דĢ¬£ØĢīĘ½ŗā”¢²»Ę½ŗā£©£»
£Ø2£©ŅŖŹ¹·“Ó¦ŌŚ8minŗó£¬Ę½ŗāĻņÄę·½ĻņŅĘ¶Æ£¬æɲÉČ”µÄ“ėŹ©ŹĒ__ ___£¬ŅŖŹ¹·“Ó¦ŌŚ8minŗ󣬷“Ó¦ĖŁĀŹ½µµĶ£¬Ę½ŗāĻņÕż·½ĻņŅĘ¶Æ£¬æɲÉČ”µÄ“ėŹ©ŹĒ________”££ØĢīa,b,c,d£©
a£®Ōö¼ÓĖ®ÕōĘų b£®½µµĶĪĀ¶Č c£®Ź¹ÓĆ“ß»Æ¼Į d£®Ōö¼ÓĒāĘųÅضČ
£Ø3£©Ēó³ö850”ę Ź±£¬øĆ·“Ó¦µÄĘ½ŗā³£ŹżŗĶCOµÄĘ½ŗā×Ŗ»ÆĀŹ£ØŠ“³öĻźĻø¼ĘĖć¹ż³Ģ£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
ŌŚÄ³ĆܱÕČŻĘ÷ÄŚÓŠÕż·“Ó¦ĪŖ·ÅČȵÄæÉÄę·“Ó¦£¬ĘäÖŠA”¢BĪŖĘųĢ壬CĪŖ¹ĢĢ壬Čō·“Ó¦æŖŹ¼¾ sŗó“ļĘ½ŗā”£ČēĶ¼£ŗ
sŗó“ļĘ½ŗā”£ČēĶ¼£ŗ
(1)øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ_________________________
(2)·“Ó¦ĪļµÄ×Ŗ»ÆĀŹ______________________
(3)ŅŖŹ¹·“Ó¦ĪļµÄ×Ŗ»ÆĀŹŌö¼ÓæÉÄܵÄŌŅņŹĒ____________
A£®Ōö“óĮĖB»ņCµÄÅØ¶Č B£®Ź¹ÓĆĮĖ“߻ƼĮ
C£®ĖõŠ”Ģå»ż£¬Ź¹ĢåĻµŃ¹ĒæŌö“ó D£®ÉżøßĮĖ·“Ó¦ĪĀ¶Č
(4)øĆ·“Ó¦“ļµ½Ę½ŗāŗó£¬ĻņøĆČŻĘ÷ÖŠŌŁ³äČė0.5molµÄHe”£ČōŗćĪĀŗćŃ¹£¬£¬ÕāŹ±·“Ó¦ĖŁĀŹ _________£ØĢī”°¼Óæģ”±”¢”°¼õĀż”±»ņ”°²»±ä”±£©£¬Ę½ŗā_____________ £ØĢī”°ĻņÕż·½ĻņŅĘ¶Æ”±”¢”°ĻņÄę·½ĻņŅĘ¶Æ”±”¢”°²»ŅĘ¶Æ”±£©£»ČōŗćĪĀŗćČŻŹ±£¬ÕāŹ±·“Ó¦ĖŁĀŹ_______£ØĢī”°¼Óæģ”±”¢”°¼õĀż”±»ņ”°²»±ä”±£©£¬·“Ó¦ĪļµÄ×Ŗ»ÆĀŹ___________£ØĢī”°¼Óæģ”±”¢”°¼õĀż”±»ņ”°²»±ä”±£©”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
ĻņijĆܱÕČŻĘ÷ÖŠ¼ÓČė0.15mol/L A”¢0.05mol/L CŗĶŅ»¶ØĮæµÄBČżÖÖĘųĢ唣Ņ»¶ØĢõ¼žĻĀ·¢Éś·“Ó¦£¬ø÷ĪļÖŹÅضČĖꏱ¼ä±ä»ÆČēĻĀĶ¼ÖŠ¼×Ķ¼ĖłŹ¾£Ūt0Ź±c( B)Ī“»³ö£¬t1Ź±Ōö“óµ½0.05mol/L£Ż”£ŅŅĶ¼ĪŖ t2Ź±æĢŗóøı䷓ӦĢõ¼ž£¬Ę½ŗāĢåĻµÖŠÕż”¢Äę·“Ó¦ĖŁĀŹĖꏱ¼ä±ä»ÆµÄĒéæö”£
£Ø1£©Čōt4Ź±øıäµÄĢõ¼žĪŖ¼õŠ”Ń¹Ēæ,ŌņBµÄĘšŹ¼ĪļÖŹµÄĮæÅضČĪŖ mol/L£»
øĆ·“Ó¦µÄĘ½ŗā³£Źż±ķ“ļŹ½ĪŖK= ”£
£Ø2£©Čōt5Ź±øıäµÄĢõ¼žŹĒÉżĪĀ£¬“ĖŹ±v(Õż) > v(Äę)£¬Ę½ŗā³£ŹżKµÄÖµ½« £ØŃ”Ģī”°Ōö“ó”±”¢”°¼õŠ””±»ņ”°²»±ä”±£©”£
£Ø3£©Čō t1= 15s£¬Ōņt0~ t1½×¶ĪŅŌC ÅØ¶Č±ä»Æ±ķŹ¾µÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖv(C)=
mol/L”¤s”£t3Ź±øıäµÄijŅ»·“Ó¦Ģõ¼žæÉÄÜŹĒ £ØŃ”ĢīŠņŗÅ£©”£
a£®Ź¹ÓĆ“ß»Æ¼Į b£®Ōö“óŃ¹Ēæ c£®Ōö“ó·“Ó¦ĪļÅØ¶Č d£®½µµĶ²śĪļÅضČ
£Ø4£©ČōAµÄĪļÖŹµÄĮæ¼õÉŁ0.02molŹ±£¬ČŻĘ÷ÓėĶā½ēµÄČČ½»»»×ÜĮæĪŖa kJ£¬Š“³öøĆ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ ”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com