
【题目】工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:

(1)金属M为 。
(2)加入H2O2的作用是(用离子方程式表示) ,加入氨水的作用是 。
(3)CoC2O4﹒2H2O高温焙烧的化学方程式为 。
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表。操作2中,蒸发浓缩后必须趁热过滤,其目的是 ,90℃时Ksp(Li2CO3)的值为 。
温度/℃ | 10 | 30 | 60 | 90 |
浓度/molL-1 | 0.21 | 0.17 | 0.14 | 0.10 |
【答案】(1)Cu;
(2)2Fe2++H2O2+2H+=2Fe3++2H2O;调节溶液的pH使Fe3+转化为Fe(OH)3沉淀;
(3)4CoC2O42H2O+3O2 ![]() 2Co2O3+8 H2O+8CO2 ;
2Co2O3+8 H2O+8CO2 ;
(4)减少Li2CO3的溶解损失;4.0×10-3 ;
【解析】试题分析:合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)加入盐酸过滤得到金属M为不与盐酸反应的铜,浸出液中加入过氧化氢氧化亚铁离子为铁离子,加入氨水调节溶液PH使铁离子转化为氢氧化铁沉淀,通过操作Ⅰ过滤得到溶液A中加入草酸铵溶液沉淀钴离子过滤得到溶液B主要是锂离子的溶液,加入碳酸钠沉淀锂离子,过滤得到碳酸锂;结晶析出CoC2O42H2O足量空气煅烧得到氧化钴,
(1)上述分析判断金属M为Cu,故答案为:Cu;
(2)加入H2O2的作用是氧化亚铁离子为铁离子,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;加入氨水的作用是调节溶液PH使Fe3+转化为Fe(OH)3沉淀,故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;调节溶液的pH使Fe3+转化为Fe(OH)3沉淀;
(3)CoC2O4焙烧生成Co2O3、CO2和水,反应的化学方程式为4CoC2O42H2O+3O2![]() 2Co2O3+8 H2O+8CO2,故答案为:4CoC2O42H2O+3O2
2Co2O3+8 H2O+8CO2,故答案为:4CoC2O42H2O+3O2![]() 2Co2O3+8 H2O+8CO2;
2Co2O3+8 H2O+8CO2;
(4)Li2CO3微溶于水,溶解度随温度升高而降低,为减少Li2CO3的溶解损失,蒸发浓缩后必须趁热过滤,90℃时c(Li2CO3)的浓度为0.10mol/L,则c(Li+)=0.20mol/L,c(CO32-)=0.10mol/L,则Ksp(Li2CO3)=0.20×0.20×0.10=4.0×10-3,故答案为:减少Li2CO3的溶解损失;4.0×10-3。


科目:高中化学 来源: 题型:
【题目】把NaHCO3和Na2O2的混合物放在密闭容器中加热,关于混合物加热前后与足量盐酸反应消耗盐酸的量,下列判断正确的是
A. 加热前后一样多
B. 加热前消耗的多
C. 加热后消耗的多
D. 当Na2O2适量时才会一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种用于合成γ-分泌调节剂的药物中间体,其合成路线流程图如下:

(1)C中的含氧官能团名称为_______和__________。
(2)D→E 的反应类型为__________________________。
(3)写出同时满足下列条件的C的一种同分异构体的结构简式:_____________________。 ①含有苯环,且分子中有一个手性碳原子;②能发生水解反应,水解产物之一是α-氨基酸,另一水解产物分子中只有2种不同化学环境的氢。
(4)G 的分子式为C12H14N2O2 ,经氧化得到H,写出G的结构简式:__________________。
(5)已知: ![]() (R代表烃基,R'代表烃基或H) 请写出以
(R代表烃基,R'代表烃基或H) 请写出以![]() 和(CH3)2SO4为原料制备
和(CH3)2SO4为原料制备![]() 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干) __________________。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干) __________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常用工业酒精和生石灰混合蒸馏法制取无水乙醇。如图是实验室中模拟工业原理制取无水乙醇的装置。

回答下列问题:
(1)指出图中的几处错误:____________________________。
(2)在除去工业酒精中的水时,下列做法不可取的是____________。
A.加入过量的生石灰后过滤
B.加入过量的生石灰后蒸馏
C.加入过量的生石灰后分液
(3)由(2)可知除去工业酒精中的水的原理是(用化学方程式表示):_____________。
(4)装置中仪器A、B、C的名称分别是:A____________;B_______________;C_____________。
(5)在蒸馏操作中,仪器B中加入沸石(或碎瓷片)的作用是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下有①6.72 L CH4 ②3.01×1023个HCl ③13.6 g H2S ④0.2 mol NH3,下列对四种气体的关系表示不正确的是
A. 体积④<①<③<② B. 密度①<④<③<②
C. 质量④<①<③<② D. 氢原子数④<②<③<①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A. 由①中的红棕色气体,推断产生的气体一定是混合气体
B. 红棕色气体不能表明②中木炭与浓硝酸产生了反应
C. 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D. ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲用NaOH固体配制1.0 mol·L-1的NaOH溶液240 mL:
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤移液 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为____________________。
(2)本实验用到的玻璃仪器有________________(至少回答3个)。
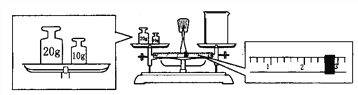
(3) 某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图。烧杯的实际质量为________g,要完成本实验该同学应称出______g NaOH。
(4)在配制过程中,其他操作都是正确的,下列操作会引起所配溶液浓度偏高的是_____(填序号)
①没有洗涤烧杯和玻璃棒
②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。
(1)SCR(选择性催化还原)工作原理:
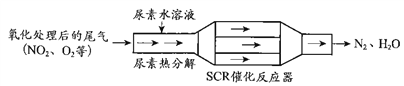
① 尿素[CO(NH2)2]水溶液热分解为NH3和CO2,该反应的化学方程式:____________。
② 反应器中NH3还原CO2的化学方程式:____________。
③ 当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4,使催化剂中毒。用化学方程式表示(NH4)2SO4的形成:________。
④ 尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60 mg·L1)含量的方法如下:取a g尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的v1 mL c1 mol·L1 H2SO4溶液吸收完全,剩余H2SO4用v2 mL c2 mol·L1 NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是_________。
(2)NSR(NOx储存还原)工作原理:
NOx的储存和还原在不同时段交替进行,如图a所示。
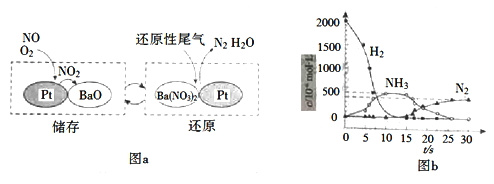
① 通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原。储存NOx的物质是_________。
② 用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。第一步反应消耗的H2与Ba(NO3)2的物质的量之比是__________。
③ 还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与NO有关。在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。将该反应的化学方程式补充完整:_______![]() □15NNO+□H2O
□15NNO+□H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法错误的是
A. 碳酸氢钠可用于治疗胃酸过多 B. 二氧化氯可用于生活用水消毒
C. 碳纳米管属于有机高分子材料,可用于储存氢气 D. 过氧化钠可用于呼吸面具供氧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com