
【题目】下列物质的俗名与化学式对应正确的是
A.熟石灰——CaOB.水晶——H2O
C.干冰——CO2D.漂白粉——NaClO
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列说法正确的是
A. 常温常压下,11.2L甲烷中含有的共价键数为2NA
B. 1 mol OH-中含有9NA个电子
C. 1L1mol·L-1AlCl3溶液中含有NA个Al3+
D. 3.2g由O2和O3组成的混合气体中含有的氧原子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以软锰矿(主要成分为MnO2、SiO2、Al2O3)和黄铁矿(FeS2、SiO2)为原料冶炼金属锰的工艺流程如图所示:

已知相关金属离子[c(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH如下:
金属离子 | Fe3+ | Mn2+ | Al3+ |
开始沉淀的pH | 2.7 | 8.3 | 3.2 |
沉淀完全的pH | 3.7 | 9.8 | 5.0 |
回答下列问题:
(1)MnO2本身不能溶于硫酸,但是在Fe2+的作用下却能溶解,写出该反应的离子方程式:____________________________。
(2)滤渣1的成分除了SiO2外,还有一种淡黄色的物质是_______________(填化学式)。
(3)除杂步骤中加入的MnCO3的作用是____________________________,该过程需调节溶液pH的范围是___________________________,若把pH调得过高,其后果是_________________________。
(4)用惰性电极进行电解,电解刚开始时阴极的电极反应式为____________________,电解后阳极的电解质溶液可返回_______________________(填“酸浸”“除杂”或“电解”)工序继续使用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,铁元素被氧化的是
A. FeS+2HCl=FeCl2+H2S↑ B. Fe+H2S04=FeS04+H2↑
C. FeO+2HCl=FeCl2+H20 D. Fe203+3CO![]() 2Fe+3C02
2Fe+3C02
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用50mL0.50mol/L的盐酸与50mL0.55mol/L的氢氧化钠溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量计算中和热。请回答下列问题:
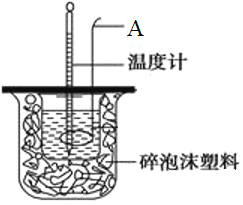
(1)写出仪器A的名称______________;
(2)碎泡沫塑料的作用是__________________________;
(3)实验测得放出的热量为1.4kJ,写出其表示中和热的化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组进行Fe(OH)3胶体的制备实验并检验其相关性质。
(1)若向装有饱和FeCl3溶液的烧杯中分别滴入下列物质中,能形成胶体的是_______(填序号)。
a.冷水 b.沸水 c.NaOH浓溶液 d.NaCl浓溶液
(2)写出制备Fe(OH)3胶体的化学方程式:_____________________
(3)用激光笔照射装有Fe(OH)3胶体的烧杯,能在侧面看到一条_________,这种现象称为丁达尔效应
(4)Fe(OH)3胶体与Fe(OH)3沉淀的本质区别是________(填序号)。
a.分散质粒子大小不同 b.颜色不同 c.后者不稳定
(5)若向制得的胶体中再加入稀HCl,红褐色分散系会被破坏,变为黄色溶液,写出相关离子方程式 ____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:

注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为_________________________。
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH________(填“增大”、“不变”或“减小”)。
(3)“电解Ⅰ”是电解熔融 Al2O3,电解过程中作阳极的石墨易消耗,原因是____________________。阴极的电极反应式为_____________________。
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。

阴极的电极反应式为________________,阴极处溶液的pH变化________。(填变大、不变、变小)
(5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:P4(g)+6Cl2(g)===4PCl3(g) ΔH=a kJ·mol-1,
P4(g)+10Cl2(g)===4PCl5(g) ΔH=b kJ·mol-1,
又知形成或拆开1 mol化学键放出或吸收的能量称为该化学键的键能。P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ·mol-1,PCl3中P-Cl键的键能为1.2c kJ·mol-1。下列叙述正确的是
A. P-P键的键能大于P-Cl键的键能
B. 可求Cl2(g)+PCl3(g)===PCl5(s)的反应热ΔH
C. Cl-Cl键的键能为(b-a+5.6c)/4 kJ·mol-1
D. P-P键的键能为(5a-3b+12c)/8 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com