
| A.①②③⑤ | B.②⑤ |
| C.①②③④⑤ | D.全部 |


科目:高中化学 来源:不详 题型:单选题
 是常规核裂变产物之一,可以通过测定大气或水中
是常规核裂变产物之一,可以通过测定大气或水中 的含量变化检测核电站是否发生放射性物质泄漏。下列有关
的含量变化检测核电站是否发生放射性物质泄漏。下列有关 的叙述中错误的是( )
的叙述中错误的是( )A. 的化学性质与 的化学性质与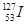 相同 相同 | B. 的原子序数为53 的原子序数为53 |
C. 的原子核外电子数为78 的原子核外电子数为78 | D. 的原子核内中子数多于质子数 的原子核内中子数多于质子数 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| ① | | | ||||||
| | | | | ② | ③ | | ④ | |
| | ⑤ | ⑥ | ⑦ | | | | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| I/kJ·mol-1 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1800 | 2700 | 11600 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com