
| 物质 性质 | 与NaOH溶液 | 与银氨溶液 | 与钠 |
| A | 水解 | 不产生银镜 | 不反应 |
| B | 中和 | 不产生银镜 | 产生H2 |
| C | 水解 | 产生银镜 | 不反应 |


科目:高中化学 来源: 题型:
| A、①② | B、②③ | C、①③④ | D、③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 3 |
| 2 |
| T/K | 303 | 313 | 323:] |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
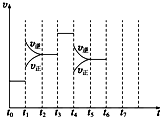 在一密闭容器中发生反应N2+3H2?2NH3△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
在一密闭容器中发生反应N2+3H2?2NH3△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| PH | 8.1 | 8.4 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 条件变化 | 平衡移动方向 | n(OH-)的变化 | c(OH-)的变化 |
| ①溶液温度升高5℃ | |||
| ②通入少量氨气 | |||
| ③加水稀释 | |||
| ④加入少量氢氧化钠固体 | |||
| ⑤加入少量氯化铵固体 | |||
| ⑥通入少量二氧化碳气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com