
| A. | ①②③ | B. | ②③⑥ | C. | ①③⑤ | D. | ②④⑥ |
分析 ①硬水与软水的区别是可溶性钙、镁化合物的含量不同;
②难溶于水也难溶于酸的BaSO4,不但没有毒,而且它具有不易被X射线透过的特点;
③铁在与水和氧气并存时容易生锈;
④酒精能使蛋白质发生变性;
⑤蚕丝的成分是蛋白质,人造羊毛的成分是化学纤维;
⑥福尔马林是甲醛的水溶液,可以使蛋白质发生变性.
解答 解:①明矾溶解于水形成胶状物,能吸附不溶的杂质小颗粒沉降下来,而硬水与软水的区别是可溶性钙、镁化合物的含量不同,与不溶性杂质无关,故①错误;
②溶于水的钡盐[如Ba(NO3)2、BaCl2等]对人体有毒,但是难溶于水也难溶于酸的BaSO4,不但没有毒,而且还由于它具有不易被X射线透过的特点,在医疗上被用作X射线透视胃肠的内服药剂--“钡餐”,故②正确;
③铁在与水和氧气并存时容易生锈,在干燥的空气中不容易生锈,故③错误;
④75%酒精能使蛋白质发生变性,故④正确;
⑤棉花的主要成分都是纤维素,蚕丝的成分是蛋白质,人造羊毛的成分是化学纤维,故⑤错误;
⑥福尔马林是甲醛的水溶液,可以使蛋白质发生变性,可用来制作生物标本,故⑥正确;
故选D.
点评 本题考查化学与生活,侧重于常识性内容的考查,难度不大,注意基础知识的积累.


科目:高中化学 来源: 题型:解答题
 醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备溴乙烷的装置如图所示,其中锥形瓶b是安全瓶,试管d中装有少量蒸馏水.已知溴乙烷的沸点为38.4℃,密度为1.43g/mL;
醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备溴乙烷的装置如图所示,其中锥形瓶b是安全瓶,试管d中装有少量蒸馏水.已知溴乙烷的沸点为38.4℃,密度为1.43g/mL;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
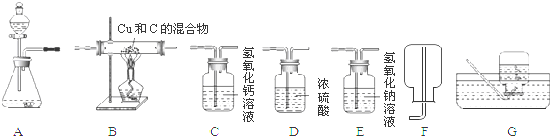
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
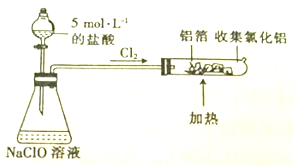
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al还原性依次减弱 | B. | I2、Br2、Cl2氧化性依次增强 | ||
| C. | C、N、O原子序数依次减小 | D. | P、S、Cl最高正价依次升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
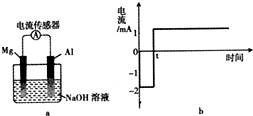 将打磨后的镁和铝平行插入1mol•L-1NaOH溶液中,用导线相连并连接电流传感器组成原电池装置(如图a),测得电流随时间变化曲线如图b所示(起始时镁作负极,t时刻电流出现反转),且镁条表面始终无明显气泡,则下列说法中错误的是( )
将打磨后的镁和铝平行插入1mol•L-1NaOH溶液中,用导线相连并连接电流传感器组成原电池装置(如图a),测得电流随时间变化曲线如图b所示(起始时镁作负极,t时刻电流出现反转),且镁条表面始终无明显气泡,则下列说法中错误的是( )| A. | 实验过程中,铝电极表面可能有气泡产生 | |
| B. | 0-t时刻,镁电极上发生反应:Mg-2e-+2OH-=Mg(OH)2 | |
| C. | t时刻时,铝和镁的金属活动性相同 | |
| D. | t时刻后,电池主要的总反应方程式:4Al+3O2+4OH-=4AlO2-+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com