
【题目】碳和硅均为元素周期表中第IV A族的元素,其单质和化合物有着重要应用。
(1)石墨烯是只有一个碳原子直径厚度的单层石墨,最早是由科学家用机械剥离的方法从石墨中分离出来,其部分性能优于传统的硅材料,具有广泛的应用前景。
①写出基态碳原子的电子排布式________。石墨烯中C的杂化类型为________。
②下图为单层石墨烯的结构示意图。12 g的石墨烯中由C原子连接成的六元环的物质的量约为________mol。

③石墨烯加氢制得的石墨烷,可用![]() 表示。下列有关叙述正确的是________。
表示。下列有关叙述正确的是________。
a.石墨烷属于烷烃 b.石墨烷难溶于水
c.石墨烷中所有碳原子共平面 d.石墨烷可以发生加成反应
④石墨烯可由加热![]() 晶体脱除
晶体脱除![]() 的方法制得。该过程属于________。
的方法制得。该过程属于________。
a.物理变化 b.分解反应 c.氧化还原反应
(2)![]() 的晶体结构与晶体硅类似。
的晶体结构与晶体硅类似。![]() 的晶体类型为________,晶体中
的晶体类型为________,晶体中![]() 原子与
原子与![]() 键的数目之比为________。
键的数目之比为________。
(3)![]() 与
与![]() 空间构型相似,但性质不同:前者不易与水反应,但后者与水剧烈反应,生成两种酸和一种气体,写出该反应的化学方程式:__________________________。
空间构型相似,但性质不同:前者不易与水反应,但后者与水剧烈反应,生成两种酸和一种气体,写出该反应的化学方程式:__________________________。
【答案】1s22s22p2 sp2杂化 0.5 b b、c 原子晶体 1:4 SiHCl3+3H2O=H2SiO3↓+3HCl+H2↑
【解析】
(1)①碳原子的核电荷数为6,其原子结构示意图为![]() ;C与相邻C形成3个C-C键,没有孤对电子;
;C与相邻C形成3个C-C键,没有孤对电子;
②石墨烯中每个碳原子形成3个碳碳键,每个碳碳键为2个碳原子共用。每个碳原子为3个六元环共用,1个六元环含有2个碳原子;
③结合烷烃和烯烃的结构特点和性质分析;
④加热![]() 晶体脱除
晶体脱除![]() 制得石墨烯,反应过程中引入碳碳双键,且C元素的化合价发生改变;
制得石墨烯,反应过程中引入碳碳双键,且C元素的化合价发生改变;
(2)晶体硅为原子晶体;晶体中每个Si原子形成4个Si-C键;
(3)SiHCl3与水剧烈反应,生成的两种酸应该是H2SiO3和HCl,结合元素的化合价升降,同时生成的气体为H2。
(1)①碳原子的核电荷数为6,其原子结构示意图为![]() ,则基态碳原子的电子排布式为1s22s22p2;C与相邻C形成3个C-C键,没有孤对电子,杂化方式均为sp2;
,则基态碳原子的电子排布式为1s22s22p2;C与相邻C形成3个C-C键,没有孤对电子,杂化方式均为sp2;
②每个碳原子形成3个碳碳键,每个碳碳键为2个碳原子共用,故每碳原子单占有的共价键为![]() =1.5,则碳原子和碳碳键的个数比是1:1.5=2:3,每个碳原子为3个六元环共用,1个六元环含有2个碳原子,12g碳的物质的量为1mol,则六元环物质的量为0.5mol;
=1.5,则碳原子和碳碳键的个数比是1:1.5=2:3,每个碳原子为3个六元环共用,1个六元环含有2个碳原子,12g碳的物质的量为1mol,则六元环物质的量为0.5mol;
③a.石墨烷的分子通式为(CH)n,不满足烷烃的分子通式CnH2n+2,则不属于烷烃,故a错误;
b.石墨烷属烃类,均难溶于水,故b正确;
c.石墨烷中所有碳原子均为sp3杂化,则所有碳原子不可能共平面,故c错误;
d.石墨烷中不存在碳碳双键,不可以发生加成反应,故d错误;
故答案为b;
④a.加热![]() 晶体脱除
晶体脱除![]() 制得石墨烯,有新物质生成,是化学变化,故a错误;
制得石墨烯,有新物质生成,是化学变化,故a错误;
b.加热![]() 晶体脱除
晶体脱除![]() 制得石墨烯,发生反应的化学方程式为SiC=Si+C,属分解反应,故b正确;
制得石墨烯,发生反应的化学方程式为SiC=Si+C,属分解反应,故b正确;
c.反应中碳、硅元素化合价发生变化,属于氧化还原反应,故c正确;
故答案为b、c;
(2)晶体硅为原子晶体,SiC的晶体结构与晶体硅类似,则SiC的晶体类型为原子晶体;晶体中每个Si原子形成4个Si-C键,则晶体中Si原子与Si-C键的数目之比为1:4;
(3)SiHCl3与水剧烈反应,生成的两种酸应该是H2SiO3和HCl,结合元素的化合价升降,同时生成的气体为H2,该反应的化学方程式为SiHCl3+3H2O=H2SiO3↓+3HCl+H2↑。


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】25℃和101kPa时,乙烷、乙炔和丙烯组成的混合烃32mL与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了72mL,原混合烃中乙炔的体积分数为( )
A.75%B.50%C.25%D.12.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 X、Y、Z、Q、W、R是常见的短周期主族元素,其相关信息如下表:
元素 | 相关信息 |
X | 它的一种同位素被用作相对原子质量的标准 |
Y | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Z | 是短周期中(除稀有气体外)原子半径最大的元素 |
Q | 最外层电子数是次外层电子数的3倍 |
W | 原子序数等于X、Y原子序数之和 |
R | 与Q同族,且最高价氧化物的水化物的浓溶液常温下使W单质钝化 |
(1)元素X在元素周期表中的位置是_______。
(2)上述六种元素中有2种元素能形成一种淡黄色的固体化合物,该化合物的电子式是_________,所含化学键的类型有离子键、____
(3)Y、Q、R三种元素的简单氢化物中,稳定性最强的化合物的结构式为________
(4)上述六种元素原子半径与主要化合价的关系如图,其中④对应的元素为_______
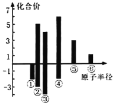
(5)将RQ2通入BaCl2溶液中,没有明显变化,再向其中加入Z的最高价氧化物的水化物,可观察到的现象是_____,发生反应的离子方程式是_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A是近年来采用的锅炉水添加剂,其结构式如图,A能除去锅炉水中溶解的氧气,下列说法正确的是( )
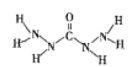
A. A分子中所有原子都在同一平面内
B. A分子中所含的σ键与π键个数之比为10:1
C. 所含C、N均为sp2杂化
D. A与O2反应生成CO2、N2、H2O的物质的量之比为1:2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于 H2O 和 H2S 的说法正确的是
A.H2O 比 H2S 稳定,是因为 H2O 分子间有氢键,而 H2S 分子间只有范德华力
B.二者中心原子杂化方式均为 sp2 杂化
C.H2S 的水溶液呈酸性,而 H2O 成中性,说明 O 元素的非金属性强于 S 元素
D.键角 H2O 大于 H2S,是因为氧的电负性大于硫,两个 O-H 键之间的排斥力大于两个 S-H 键的排斥力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 三种元素的原子具有相同的电子层数,
三种元素的原子具有相同的电子层数,![]() 原子的核电荷数比
原子的核电荷数比![]() 原子的核电荷数大2,
原子的核电荷数大2,![]() 原子的电子总数比
原子的电子总数比![]() 原子的电子总数大4;
原子的电子总数大4;![]() 单质
单质![]() 与足量
与足量![]() 溶液反应可生成
溶液反应可生成![]() (标准状况下)氢气,此时
(标准状况下)氢气,此时![]() 转化为与氖原子具有相同电子层结构的离子。
转化为与氖原子具有相同电子层结构的离子。
(1)写出各元素的名称:![]() ______,
______,![]() ______,
______,![]() ______。
______。
(2)写出![]() 的最高价氧化物对应的水化物与
的最高价氧化物对应的水化物与![]() 的简单氢化物的水溶液反应的离子方程式:____________。
的简单氢化物的水溶液反应的离子方程式:____________。
(3)![]() 形成的简单离子的氧化性比
形成的简单离子的氧化性比![]() 形成的简单离子的氧化性______ (填“强”或“弱”),其原因是______。
形成的简单离子的氧化性______ (填“强”或“弱”),其原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A.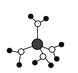 水合铜离子的模型如图所示,1个水合铜离子中有4个配位键
水合铜离子的模型如图所示,1个水合铜离子中有4个配位键
B.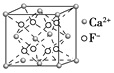 CaF2晶体的晶胞如图所示,与每个Ca2+距离最近的F-为4个
CaF2晶体的晶胞如图所示,与每个Ca2+距离最近的F-为4个
C. H原子的电子云图如图所示为球形
H原子的电子云图如图所示为球形
D. 金属Cu的原子堆积模型如图所示,为最密堆积,每个Cu原子的配位数均为12
金属Cu的原子堆积模型如图所示,为最密堆积,每个Cu原子的配位数均为12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种元素是周期表中前四周期的元素。只有A、B、C为金属且都位于第四周期,原子序数A<B<C。A、C核外均没有未成对电子,C位于ds区;B原子核外有二个未成对电子和三个空轨道。D原子最外层电子数是其周期序数的三倍。E能与D形成化合物ED2,可用于自来水的消毒。
(1)C的基态原子的价层电子排布图为__;D和E的电负性大小关系为__(用元素符号表示)。
(2)化合物E2D分子的空间构型为__,中心原子采用_杂化。E与D还可形成三角锥结构的阴离子,该离子的化学式为_,任意写出一种它的等电子体的化学式为_。
(3)B与E能形成一种化合物BE4,其熔点:-25℃,沸点:l36.4℃。则该化合物晶体内含有的作用力类型有_。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】模拟石油深加工合成CH2=CHCOOCH2CH3(丙烯酸乙酯)等物质的过程如图:
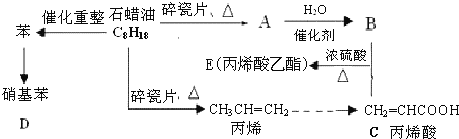
请回答下列问题:
(1)丙烯酸乙酯的含氧官能团名称为____
(2)写出下列反应的化学方程式,并指出反应类型:
①A→B:____,____反应。
②苯→硝基苯:____,____反应。
(3)纯硝基苯是无色、难溶于水,密度比水大,具有苦杏仁味的油状液体。实验室制备硝基苯的装置如图示:
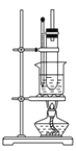
主要步骤如下:
a.配制一定比例的浓硫酸与浓硝酸混合酸,加入反应器中
b.在50~60℃下发生反应,直至反应结束
c.将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯硝基苯
d.向室温下的混合酸中逐滴加入一定质量的苯,充分振荡,混合均匀
e.除去混合酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤
回答下列问题:
①实验操作的正确顺序是____(填字母)。
②步骤b中的加热方法为____,步骤e中洗涤和分高粗硝基苯应使用的主要仪器是____,粗产品用5%NaOH溶液洗涤的目的是____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com