
【题目】某实验小组对FeCl3分别与Na2SO3、NaHSO3的反应进行探究。
(甲同学的实验)
装置 | 编号 | 试剂X | 实验现象 |
| I | Na2SO3溶液(pH≈9) | 闭合开关后灵敏电流计指针发生偏转 |
II | NaHSO3溶液(pH≈5) | 闭合开关后灵敏电流计指针未发生偏转 |
(1)怎样配制FeCl3溶液? ________________________________________________________。
(2)甲同学探究实验I的电极产物。
① 取少量Na2SO3溶液电极附近的混合液,加入_________________________________,产生白色沉淀,证明产生了SO42-。
② 该同学又设计实验探究另一电极的产物,其实验方案为_______________________________。
(3)实验I中负极的电极反应式为______________________________________________________。
乙同学进一步探究FeCl3溶液与NaHSO3溶液能否发生反应,设计、完成实验并记录如下:
装置 | 编号 | 反应时间 | 实验现象 |
| III | 0~1 min | 产生红色沉淀,有刺激性气味气体逸出 |
1~30 min | 沉淀迅速溶解形成红色溶液,随后溶液逐渐变为橙色,之后几乎无色 | ||
30 min后 | 与空气接触部分的上层溶液又变为浅红色,随后逐渐变为浅橙色 |
(4)乙同学认为刺激性气味气体的产生原因有两种可能,用离子方程式表示②的可能原因。
① Fe3++3HSO3-![]() Fe(OH)3 +3SO2;②_____________________________________________。
Fe(OH)3 +3SO2;②_____________________________________________。
![]()
从反应速率和化学平衡两个角度解释1~30 min的实验现象:______________________________。
(实验反思)
(6)分别对比I和II、II和III,FeCl3能否与Na2SO3或NaHSO3发生氧化还原反应和______________________有关(写出两条)。
【答案】将FeCl3溶于浓盐酸,再稀释至指定浓度 足量盐酸和BaCl2溶液 取少量FeCl3溶液电极附近的混合液,加入铁氰化钾溶液,产生蓝色沉淀,证明产生了Fe2+ 3SO32--2e-+H2O=SO42-+2HSO3- H++HSO3-=H2O+SO2↑ 生成红色配合物的反应速率快,红色配合物生成橙色配合物的速率较慢;在O2的作用下,橙色的HOFeOSO2浓度下降,平衡![]() 不断正向移动,最终溶液几乎无色 溶液pH不同、Na2SO3、NaHSO3溶液中SO32-浓度不同(或Na2SO3与NaHSO3不同,或Na2SO3与NaHSO3的阴离子不同)、反应物是否接触形成红色配合物(任写两条)
不断正向移动,最终溶液几乎无色 溶液pH不同、Na2SO3、NaHSO3溶液中SO32-浓度不同(或Na2SO3与NaHSO3不同,或Na2SO3与NaHSO3的阴离子不同)、反应物是否接触形成红色配合物(任写两条)
【解析】
甲同学实验:利用铁离子能够将SO32-氧化设计原电池,则原电池中氯化铁溶液为正极得电子发生还原反应,试剂X为负极,失电子发生氧化反应;实验中X为Na2SO3溶液时电流计指针发生偏转,说明铁离子将SO32-氧化;实验中X为NaHSO3溶液时电流计指针未发生偏转,说明二者可能不反应;
乙同学进一步探究FeCl3溶液与NaHSO3溶液能否发生反应:0~1 min产生红色沉淀,有刺激性气味气体逸出,红色沉淀应为Fe(OH)3,气体应为二氧化硫,说明二者发生双水解;1~30 min沉淀迅速溶解形成红色溶液,随后溶液逐渐变为橙色,之后几乎无色,结合查阅的资料可知生成了HOFeOSO2,该物质存在平衡HOFeOSO2HOFeOSO2,在氧气的作用下不断正向进行,最终溶液几乎无色;30min后反应现象是空气接触部分的上层溶液又变为浅红色,随后逐渐变为浅橙色,反应后的亚铁离子被空气中氧气氧化为铁离子,过量的HSO3-电离提供SO32-,溶液中Fe3+、SO32-、OH-三种微粒会继续反应形成红色配合物。
(1)实验室配制FeCl3溶液时,为了防止铁离子水解,先将FeCl3固体溶解在较浓的盐酸中然后加水稀释;
(2)①若有硫酸根生成,则加入盐酸酸化的氯化钡溶液会有白色沉淀生成;
②氯化铁溶液为原电池正极,发生还原反应,Fe3+被还原成Fe2+,铁氰化钾溶液可以与亚铁离子反应生成蓝色沉淀,所以方案为取少量FeCl3溶液电极附近的混合液,加入铁氰化钾溶液,产生蓝色沉淀,证明产生了Fe2+;
(3)实验I中试剂X为原电池负极,SO32-被氧化生成硫酸根,电极方程式为3SO32—2e-+H2O=SO42-+2HSO3-;
(4)pH=1的氯化铁溶液中有大量的氢离子,亚硫酸氢根离子结合氢离子生成二氧化硫气体,反应的离子方程式:H++HSO3-=H2O+SO2↑;
(5)FeCl3溶液与NaHSO3溶液混合反应,在1~30 min出现现象为:沉淀迅速溶解形成红色溶液,随后溶液逐渐变为橙色,之后几乎无色,根据资料:溶液中Fe3+、SO32-、OH-三种微粒会形成红色配合物并存在转化:HOFeOSO2HOFeOSO2![]() Fe2++SO42-,可知原因是:生成红色配合物的反应速率快,红色配合物生成橙色配合物的速率较慢;在氧气的作用下橙色的HOFeOSO2浓度下降平衡HOFeOSO2HOFeOSO2,不断正向进行,最终溶液几乎无色。
Fe2++SO42-,可知原因是:生成红色配合物的反应速率快,红色配合物生成橙色配合物的速率较慢;在氧气的作用下橙色的HOFeOSO2浓度下降平衡HOFeOSO2HOFeOSO2,不断正向进行,最终溶液几乎无色。
(6)分别对比Ⅰ和Ⅱ、Ⅱ和Ⅲ,FeCl3能否与Na2SO3或NaHSO3发生氧化还原反应和溶液pH不同、Na2SO3、NaHSO3溶液中SO32-浓度不同(或Na2SO3与NaHSO3不同,或Na2SO3与NaHSO3的阴离子不同)、反应物是否接触形成红色配合物有关。


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】(1)常温下,向20mL0.05mol·L-1的某稀酸H2B溶液中滴入0.1mol·L-1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。回答下列问题
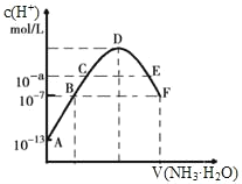
①NaHB溶液呈_______(填“酸性”“碱性”或“中性”)
②A、D、E三点溶液的pH由大到小为:_______
③F点溶液c(NH4+)_______2c(B2-)(填“>”“<”或“=”)
(2)某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
(查阅资料)25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4.0×10-38
(实验探究)向2支均盛有1mL0.1mol/LMgCl2溶液的试管中分别加入2滴2mol/LNaOH溶液,制得等量Mg(OH)2沉淀。
①分别向两支试管中加入不同试剂,请填写下表中的实验现象(用下列选项中字母代号填写)
试管编号 | 加入试剂 | 实验现象 |
Ⅰ | 2滴0.1mol/LFeCl3溶液 | _______ |
Ⅱ | 4mL2mol/LNH4Cl溶液 | _______ |
A 白色沉淀转化为红褐色沉淀 B 白色沉淀不发生改变
C 红褐色沉淀转化为白色沉淀 D 白色沉淀溶解,得无色溶液
②同学们猜想实验Ⅱ中沉淀溶解的主要原因有两种:
猜想1:NH4+结合Mg(OH)2电离出的OH-,使Mg(OH)2的沉淀溶解平衡正向移动。猜想2:_______。
(3)为验证猜想,同学们取少量相同质量的氢氧化镁固体盛放在两支试管中,一支试管中加入醋酸铵溶液(pH=7),另一支试管中加入NH4Cl和氨水混合液(pH=8),两者沉淀均溶解。该实验证明正确的是_______(填“猜想1”或“猜想2”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D为由短周期元素组成的四种物质,它们有如下所示转化关系,且D为强电解质(其他相关物质可能省略)。
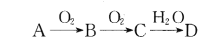
下列说法不正确的是
A. 若A为非金属单质,则它与Mg反应的产物中阴、阳离子个数比可能为2:3
B. 若A为非金属单质,则其组成元素在周期表中的位置可能处于第二周期第IVA族
C. 若A是共价化合物,则A和D有可能发生氧化还原反应
D. 若A是金属或非金属单质,则常温下0. 1 mol/L的D溶液中由水电离出的c(H+)可能为10-13mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用煤油作溶剂,二(2-乙基己基)磷酸酯作流动载体,H2SO4 作内相酸处理含铜废水。 在其他条件相同时,Cu2+萃取率[萃取率= ×100% ]与初始 Cu2+浓度关系如图 1 所示;在其他条件相同时,处理前初始 Cu2+浓度为 200 mg·L-1,Cu2+萃取率与废水 pH 的关系如图 2 所示。下列说法错误的是
×100% ]与初始 Cu2+浓度关系如图 1 所示;在其他条件相同时,处理前初始 Cu2+浓度为 200 mg·L-1,Cu2+萃取率与废水 pH 的关系如图 2 所示。下列说法错误的是
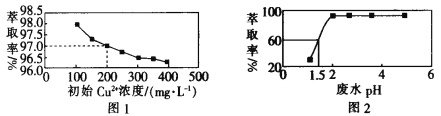
A.根据图 1 可知,废水中初始 Cu2+浓度越大,Cu2+的萃取效果越好
B.根据图 2 可知,废水初始 pH>2 时,去除 Cu2+的效果较好
C.根据图 1 可知,Cu2+初始浓度为 200 mg·L-1 时,Cu2+的萃取率为 97.0%
D.根据图 2 可知,若取 800 mL 初始 Cu2+浓度为 200 mg·L-1 的废水,在 pH=1.5 时处理废水,则处理后的废水中剩余 Cu2+的物质的量为 1.5×10-3mol(假设体积不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5 mol·L-1盐酸、0.55 mol·L-1 NaOH溶液,实验尚缺少的玻璃用品是___________、___________。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒___________(填“能”或“否”),其
原因是 。
(3)他们记录的实验数据如下:

已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ·℃-1·kg-1,各物质的密度均为1 g·cm-3。
①计算完成上表ΔH=_____________。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式: 。
(4)若用KOH代替NaOH,对测定结果__________(填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果____________(填“有”或“无”)影响。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒被称为“工业味精”“工业维生素”,在发展现代工业、国防等方面发挥着至关重要的作用。某高铬型钒渣含![]() 等物质,从中分离提取钒铬的工艺流程如下:
等物质,从中分离提取钒铬的工艺流程如下:

回答下列问题:
(1)“焙烧”时会生成![]() 和
和![]() ,生成
,生成![]() 的化学方程式是_________________________。
的化学方程式是_________________________。
(2)滤渣1中主要含_________________。滤渣2的主要成分是![]() 和
和![]() ,要使所得滤液中含有的相关金属离子浓度小于
,要使所得滤液中含有的相关金属离子浓度小于![]() ,应调
,应调![]() 不低于___。(已知:
不低于___。(已知:![]()
![]()
(3)“沉钒”所用![]() 溶液中,离子浓度由大到小的顺序是_________________________。
溶液中,离子浓度由大到小的顺序是_________________________。
(4)“还原”时溶液的![]() 在2.5左右,此时控制酸度应选用_______________(填字母标号)。
在2.5左右,此时控制酸度应选用_______________(填字母标号)。
A.稀盐酸 B.稀硫酸 C.稀硝酸 D.硫酸铵
(5)![]() 煅烧时发生反应的类型是否相同?____________(填“相同”或“不同”)
煅烧时发生反应的类型是否相同?____________(填“相同”或“不同”)
(6)工业上可用电解还原法处理含![]() 的酸性废水。用铁板作阳极,电解过程中,废水
的酸性废水。用铁板作阳极,电解过程中,废水![]() 逐渐上升
逐渐上升![]() 都以氢氧化物沉淀析出,达到废水净化的目的。
都以氢氧化物沉淀析出,达到废水净化的目的。
①其中阳极的电极反应式是_________________________。
②电解过程中,废水![]() 上升的原因是________________________________________________。
上升的原因是________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按下图所示实验装置探究铜与浓硫酸的反应,记录实验现象见下表。
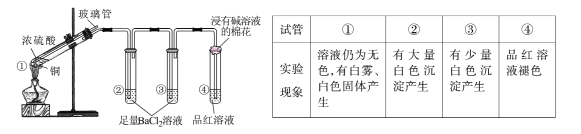
下列说法正确的是
A.②中白色沉淀是BaSO3
B.①中可能有部分硫酸挥发了
C.为确定①中白色固体是否为硫酸铜,可向冷却后的试管中注入水,振荡
D.实验时若先往装置内通入足量N2,再加热试管①,实验现象不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NM3是处于临床试验阶段的小分子抗癌药物,分子结构如图。下列说法正确的是
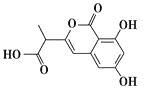
A.该有机物的分子式为C12H12O6
B.1 mol该有机物最多可以和3 mol NaOH反应
C.该有机物容易发生加成、取代、消去等反应
D.该有机物分子中只含有1个手性碳原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com