
分析 (1)根据n=$\frac{m}{M}$计算氨气物质的量;
(2)根据V=nVm计算氨气体积;
(3)根据c=$\frac{n}{V}$计算溶液物质的量浓度;
(4)原子物质的量为氨气的4倍,根据N=nNA计算原子数目;
(5)实验室利用氢氧化钙与氯化铵在加热条件下制备氨气,反应生成氯化钙、氨气与水.
解答 解:(1)34g NH3气体的物质的量为$\frac{34g}{17g/mol}$=2mol,故答案为:2;
(2)标况下,氨气的体积为2mol×22.4L/mol=44.8L,故答案为:44.8;
(3)溶于水配成1L溶液,所得溶液物质的量浓度为$\frac{2mol}{1L}$=2mol/L,故答案为:2mol/L;
(4)原子物质的量为氨气的4倍,含有原子数目数目为2mol×4×NAmol-1=8NA,故答案为:8NA;
(5)实验室利用氢氧化钙与氯化铵在加热条件下制备氨气,反应生成氯化钙、氨气与水,反应方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O,故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O.
点评 本题考查物质的量有关计算、氨气实验室制备原理,比较基础,掌握以物质的量为中心的计算.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 木材纤维和土豆淀粉遇碘水均显蓝色 | |
| B. | 食用花生油和鸡蛋清都能发生水解反应 | |
| C. | 包装用材料聚乙烯和聚氯乙烯都属于烃 | |
| D. | 经常使用一次性筷子、纸杯、塑料袋等做法能保护环境 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 残留固体中一定不含有铁 | B. | 滤液中可能含有Fe3+ | ||
| C. | 原混合物中n(Fe)=n(Fe2O3)+n(CuO) | D. | 原混合物中铁为3.36 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
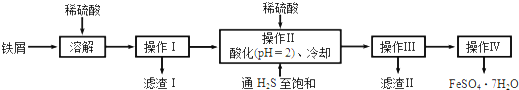
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “哑泉”之毒是由于水中的Cu2+使人体中的蛋白质分解 | |
| B. | “哑泉”之毒是由于水中的SO42-使人体中的蛋白质变性 | |
| C. | “哑泉”之毒是由于水中的Cu2+水解显酸性使人体中的蛋白质变性 | |
| D. | “安乐泉”能解“哑泉”之毒的离子方程式为Cu2++2OH-=Cu(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
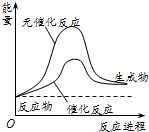
| A. | 反应物的状态 | B. | 反应的完成程度 | C. | 生产能耗 | D. | 反应热效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
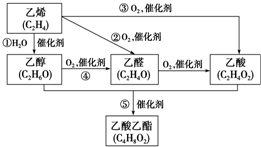 如图是由乙烯合成乙酸乙酯的几种可能的合成路线:
如图是由乙烯合成乙酸乙酯的几种可能的合成路线: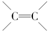 ,乙醇中含氧官能团的名称是羟基;
,乙醇中含氧官能团的名称是羟基;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
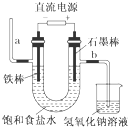
| A. | 装置中,a管能产生氢气 | |
| B. | 在石墨棒电极区域有NaOH产物 | |
| C. | b管导出的是氯气 | |
| D. | 以食盐水为基础原料制取氯气等产品的工业称为“氯碱工业” |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com