
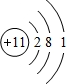 .
.分析 现有A、B、C、D、E、F六种短周期元素,原子序数依次增大.A原子半径是所有元素中最小的,则A为H元素;A与D同主族,二者原子序数相差至少为3,故D为Na;B元素的气态氢化物与最高价氧化物对应水化物反应可以生成盐,则B为N元素;C原子最外层电子数是内层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故C为O元素;D、E、F同周期,即处于第三周期,C与E分别同主族,则E为S元素,故F为Cl,据此解答.
解答 解:现有A、B、C、D、E、F六种短周期元素,原子序数依次增大.A原子半径是所有元素中最小的,则A为H元素;A与D同主族,二者原子序数相差至少为3,故D为Na;B元素的气态氢化物与最高价氧化物对应水化物反应可以生成盐,则B为N元素;C原子最外层电子数是内层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故C为O元素;D、E、F同周期,即处于第三周期,C与E分别同主族,则E为S元素,故F为Cl.
(1)元素B为N元素,在周期表中的位置是:第二周期VA族,D为Na元素,原子结构示意图为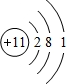 ,故答案为:第二周期第ⅤA族;
,故答案为:第二周期第ⅤA族;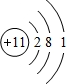 ;
;
(2)H2O分子间有氢键,H2S分子间不能形成氢键,所以沸点比H2S高,故答案为:H2O;H2O分子间存在氢键而H2S分子间不能形成氢键;
(3)元素H、N、Cl形成的离子化合物为NH4Cl,元素D的最高价氧化物对应水化物为NaOH,二者反应生成NaCl、氨气与水,反应离子方程式为NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,故答案为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;
(4)工业上电解饱和氯化钠溶液制备氯气,化学方程式为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;
(5)化合物N2H4和N2O4的液体曾被用作火箭推进剂,燃烧反应的生成物是一种气态单质和一种化合物,它们对环境无污染,生成氮气与液态水,1mol N2H4与N2O4完全反应生成两种气体时放出热量516.8kJ,则2molN2H4反应放出的热量为516.8kJ×2=1033.6kJ,则该反应的热化学方程式为:2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g)△H=-1033.6 kJ•mol-1,故答案为:2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g)△H=-1033.6 kJ•mol-1.
点评 本题考查位置结构性质关系综合应用,涉及原子结构示意图、氢键对物质性质影响、电解原理应用、热化学方程式的书写等,难度中等,推断元素是解题关键.


科目:高中化学 来源: 题型:解答题
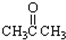 ③CH3CH2Br④
③CH3CH2Br④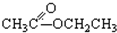 ⑤
⑤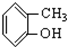 ⑥
⑥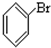 ⑦
⑦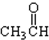 ⑧
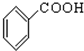
⑧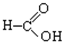 ⑨
⑨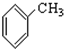 (10))
(10))
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 $→_{H_{2}O}^{HCl}$
$→_{H_{2}O}^{HCl}$
 $→_{②Zn/H_{2}O}^{①O_{3}}$
$→_{②Zn/H_{2}O}^{①O_{3}}$
 .
. ;该反应类型酯化反应
;该反应类型酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W、Y、Z三种元素的最高价氧化物的水化物可能有两种是强碱、一种是强酸 | |
| B. | Z元素在第3周期第ⅥA族 | |
| C. | W、Y、Z三种元素有两种是金属、一种是非金属 | |
| D. | W、X、Y三种元素最高价氧化物对应水化物的碱性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 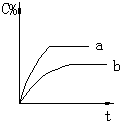 | B. | 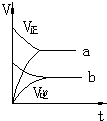 | C. |  | D. | 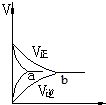 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积减半,则压强为原来的两倍 | |
| B. | 平衡向右移动,混合气体的颜色一定会变浅 | |
| C. | 体积减半,压强增大,但小于原来的2倍 | |
| D. | 体积减半,压强增大,且大于原来的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
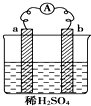
| A. | 反应后a极质量减小 | |
| B. | 碳棒上有气体逸出 | |
| C. | 导线上有电流,电子流动方向从a→b | |
| D. | a极上发生还原反应,b极上发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
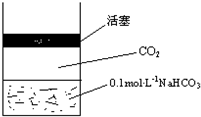 在常温下,碳酸的电离常数Ka1=4.3×10-7、Ka2=5.6×10-11,如图所示的装置中,若活塞下移,下列说法不正确的是( )
在常温下,碳酸的电离常数Ka1=4.3×10-7、Ka2=5.6×10-11,如图所示的装置中,若活塞下移,下列说法不正确的是( )| A. | 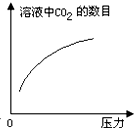 | B. | 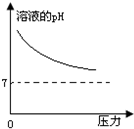 | C. |  | D. | 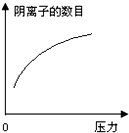 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com