
丙烯可看作是乙烯分子中的一个氢原子被-CH3取代的产物,由乙烯推测丙烯的结构或性质,正确的是( )
A.分子中三个碳原子在同一直线上 B.分子中所有原子都在同一平面上
C.与HCl加成只生成一种产物 D.丙烯可以使酸性高锰酸钾溶液褪色
 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:选择题

| A. | 甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O | |
| B. | 若乙池中为足量AgNO3溶液,则阳极的电极反应为:4OH--4e-═2H2O+O2↑ | |
| C. | 若乙池中为一定量CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1molCu(OH)2后恰好恢复到电解前的浓度和pH,则电解过程中转移的电子数为0.2NA | |
| D. | 常温常压下,1gCH3OH燃料生成CO2和液态H2O时放热22.68 kJ,表示该反应的热化学方程式为:CH3OH(l)+1.5O2(g)═CO2(g)+2H2O(l)△H=-725.76 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 )共聚而成,则单体A可能为( )
)共聚而成,则单体A可能为( )| A. | C2H5-CH═CH-CH3 | B. |  | C. |  | D. | CH3C═CH-CH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北石家庄辛集中学高二上阶段考一化学卷(解析版) 题型:选择题
一定量的甲烷在O2不足的情况下燃烧,得到CO、CO2和H2O的总质量为14.4 g,若其中水的质量为7.2 g,则CO的质量是( )
A.2.8g B.4.4g C.5.6g D.在2.8 g~5.6 g之间
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北石家庄辛集中学高二上阶段考一化学卷(解析版) 题型:选择题
下列关于同系物的说法中,错误的是( )
A.同系物具有相同的最简式
B.同系物能符合同一通式
C.同系物中,相邻的同系物彼此在组成上相差一个CH2原子团
D.同系物的化学性质基本相似,物理性质随碳原子数增加而呈规律性变化
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北石家庄辛集中学高二上阶段考一化学卷(解析版) 题型:选择题
常温时,下列混合溶液的pH 一定小于7的是( )
A.pH = 3的盐酸和pH = ll的氨水等体积混合
B.pH = 3的盐酸和pH = 11的氢氧化钡溶液等体积混合
C.pH = 3的硫酸和pH = ll的氨水等体积混合
D.pH = 3的醋酸和pH = ll的氨氧化钡溶液等体积混合
查看答案和解析>>
科目:高中化学 来源:2017届江西省鹰潭市高三上学期第四次月考化学试卷 题型:选择题
向铁铜合金中加入硝酸溶液恰好完全反应,得到NO2、N2O4、NO混合气体,向反应后溶液中加入2mol/LNaOH溶液,至沉淀恰好完全。若将得到的NO2、N2O4、NO混合气体,与2.24L(标准状况下)O2混合后通入水中恰好被完全吸收生成硝酸。则反应中消耗的NaOH溶液的体积是
A.150ml
B.180ml
C.200ml
D.250ml.
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三上学期第三次月考模拟化学试卷 题型:简答题
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:

(1)已知:2Cu(s)+1/2O2(g)=Cu2O(s);△H=akJ·mol-1
C(s)+1/2O2(g)=CO(g);△H=bkJ·mol-1
Cu(s)+1/2O2(g)=CuO(s);△H=ckJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g);△H=_________kJ·mol-1
(2)工业上极少用方法I制取Cu2O是由于方法I反应条件不易控制,若控温不当,会降低Cu2O产率,请分析原因:________________。
(3)方法II为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为_________________________。
(4)方法III采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如下图所示:写出电极反应式并说明该装置制备Cu2O的原理___________________。
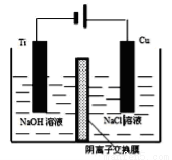
(5)在相同的密闭容器中.用以上两种方法制得的Cu2O分别进行催化分解水的实验:
 △H>0,水蒸气的浓度(mol/L)随时间t(min)变化如下表所示:
△H>0,水蒸气的浓度(mol/L)随时间t(min)变化如下表所示:

下列叙述正确的是_________(填字母)。
A.实验的温度:T2<T1
B.实验①前20min的平均反应速率v(O2)=7×10-5mol·L-1·min-1
C.实验②比实验①所用的Cu2O催化效率高
D.实脸①、②、③的化学平衡常数的关系:K1=K2<K3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com