有A、B、C、D、E五种短周期元素,它们的核电荷数依次增大.A、D 都能分别与B按原子个数比为1:1 或2:1形成化合物;AC可与EB2反应生成A2B与气态物质EC4;E的M层电子数是K层电子数的2倍.
(1)画出E的原子结构示意图______;写出电子式D2B2______;写出化学式EC4______.
(2)比较EB2与EC4的沸点高低(填化学式)______>______.
(3)用电子式表示化合物DC的形成过程______.
【答案】
分析:A、B、C、D、E五种短周期元素,它们的核电荷数依次增大,A、D 都能分别与B按原子个数比为1:1 或2:1形成化合物,则A为H,B为O,D为Na;E的M层电子数是K层电子数的2倍,则E的质子数为14,即E为Si;AC可与EB
2反应生成A
2B与气态物质EC
4,该反应为4HF+SiO
2═2H
2O+SiF
4↑,则C为F,然后利用元素及其单质、化合物的性质来解答.
解答:解:A、B、C、D、E五种短周期元素,它们的核电荷数依次增大,A、D 都能分别与B按原子个数比为1:1 或2:1形成化合物,则A为H,B为O,D为Na;E的M层电子数是K层电子数的2倍,则E的质子数为14,即E为Si;AC可与EB
2反应生成A
2B与气态物质EC
4,该反应为4HF+SiO
2═2H
2O+SiF
4↑,则C为F,
(1)E为Si,质子数为14,最外层电子数为4,原子结构示意图为
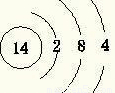
,D
2B
2为Na
2O
2,电子式为
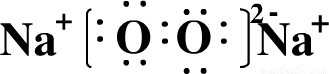
,
EC
4为SiF
4,故答案为:
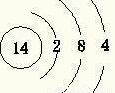
;
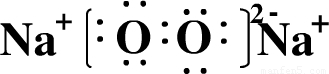
;SiF
4;
(2)SiO
2为原子晶体,熔沸点较高,SiF
4为分子晶体,熔沸点较低,沸点SiO
2>SiF
4,故答案为:SiO
2;SiF
4;
(3)NaF为离子化合物,形成过程为

,故答案为:

.
点评:本题考查原子结构、元素周期律、元素的性质,熟悉元素形成的常见化合物是解答本题的关键,注意二氧化硅的特性来解答.

 ,D2B2为Na2O2,电子式为
,D2B2为Na2O2,电子式为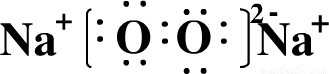 ,
, ;
;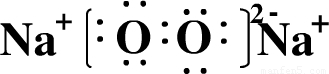 ;SiF4;
;SiF4; ,故答案为:
,故答案为: .
.












