
【题目】通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是
现象 | 解释 | |
A | 用洁净的铂丝蘸取某溶液进行焰色反应,火焰呈黄色 | 该溶液中一定含有 |
B |
|
|
C | 某溶液中先加入稀盐酸无现象,再加入氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有 |
D | 铁加入稀硝酸中有气泡产生 | 铁与稀硝酸发生了置换反应 |
A.AB.BC.CD.D
 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
课课练江苏系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作及对应解释或结论正确的是![]()
选项 | 实验操作 | 解释或结论 |
A | 向某溶液中滴加盐酸酸化的 | 原溶液中一定含有 |
B | 将 |
|
C | 用蒸馏水润湿的pH试纸测溶液的pH | 一定会使测定结果偏低 |
D | 向混有乙酸和乙醇的乙酸乙酯中加入氢氧化钠溶液 | 除去溶液中的乙酸和乙醇 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.c(H+)=![]() 的溶液一定呈中性
的溶液一定呈中性
B.将水加热,KW增大,pH不变,仍呈中性
C.向水中加入少量碳酸氢钠固体,溶液的c(H+) 增大,KW不变
D.向0.1mol·L-1醋酸溶液中加水,溶液中水电离产生的c(H+)将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到预期目的是
A.向某无色溶液中加入![]() 溶液产生不溶于稀
溶液产生不溶于稀![]() 的白色沉淀,说明原溶液中一定有
的白色沉淀,说明原溶液中一定有![]()
B.向某无色溶液中加入盐酸,有无色无味的气体产生,则说明原溶液中一定有![]()
C.利用碘在水中和有机溶剂中溶解度的差异,向碘水中加入![]() 萃取碘
萃取碘
D.从实验室加热氯酸钾与![]() 的混合物制氧气后的剩余物中回收二氧化锰的操作顺序是溶解、蒸发、洗涤、过滤
的混合物制氧气后的剩余物中回收二氧化锰的操作顺序是溶解、蒸发、洗涤、过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水在25 ℃和95 ℃时,其电离平衡曲线如下图所示:
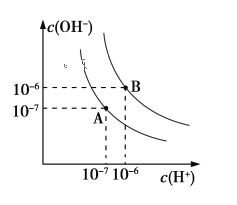
(1)则25 ℃时水的电离平衡曲线应为_______(填“A”或“B”),请说明理由_____________________。
(2)25 ℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若混合溶液的pH=7,则NaOH溶液与pH=4的H2SO4溶液的体积比为________。
(3)95 ℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,a+b=_______________
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5,则HA为_______(填“强”或“弱”)酸
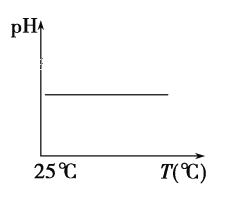
(5)下列溶液pH随温度的变化如图所示的是______(不考虑溶质、溶剂挥发)
a.稀硫酸 b.NaOH溶液 c.NaCl 溶液 d.氨水 e.醋酸
(6)下表室温下为几种弱电解质的电离平衡常数
CH3COOH | H2CO3 | H2S | NH3·H2O |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | 1.8×10-5 |
少量CO2与NaHS反应的离子方程式为_________________________________________。室温下,CH3COONH4溶液的pH_________7(填“>”、“<”或“=”)
(7)25 ℃时,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1 NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,原因是___________________________________________(用离子方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知KMnO4与浓HCl在常温下反应能产生Cl2。若用下图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中错误的是( )

A.只有①和②处B.只有②处C.只有②和③处D.只有②③④处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有![]() 、
、![]() 、Si
、Si![]() 、Br-、C
、Br-、C![]() 、Na+,向该溶液中通入过量的Cl2,下列判断正确的是( )
、Na+,向该溶液中通入过量的Cl2,下列判断正确的是( )
①反应前后,溶液中离子浓度基本保持不变的有![]() 、Na+
、Na+
②有胶状物质生成
③有气体产生
④溶液颜色发生变化
⑤共发生了2个氧化还原反应
A.①②③④B.②③④
C.①③⑤D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫和氮氧化物都是常见的大气污染物,回答下列相关问题。
Ⅰ.某温度下氮氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
i. 2NO(g)+Cl2(g)![]() 2ClNO(g) △H1<0其平衡常数为K1
2ClNO(g) △H1<0其平衡常数为K1
ii. 2NO2(g)+NaCl(s) ![]() NaNO3(s)+ClNO(g) △H2<0 其平衡常数为K2
NaNO3(s)+ClNO(g) △H2<0 其平衡常数为K2
(1)现有反应4NO2(g)+2NaCl(s) ![]() 2NaNO3(s)+2NO(g)+Cl2(g), 则此反应的平衡常数K3=_______(用K1、K2表示),反应热△H3=_____(用△H1、△H2表示)。
2NaNO3(s)+2NO(g)+Cl2(g), 则此反应的平衡常数K3=_______(用K1、K2表示),反应热△H3=_____(用△H1、△H2表示)。
(2)为研究不同条件对反应ii的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO2和足够的NaCl(s),10min时反应ii达到平衡。测得平衡时NO2的转化率α1(NO2) =50%,则:10min内υ(ClNO) =___________________,平衡常数K2=_________________;
II.除氮氧化物外,SO2也是重要的大气污染物,需要对其进行吸收处理。
(3)若用一定量的NaOH溶液吸收SO2气体后所得吸收液恰好呈中性,下列有关吸收液中粒子关系正确的是______________。
A.c(Na+) = c(HSO3-)+ 2c(SO32-)
B.c(Na+) > c(HSO3-) =c(SO32-) > c(H+) = c(OH—)
C.2c(Na+) =3c(H2SO3)+3c(HSO3-)+3c(SO32-)
D.c(Na+) > c(HSO3—) + c(SO32—) +c(H2SO3)
(4)工业上也可以用Na2SO3溶液吸收SO2,并用电解法处理吸收后所得溶液以实现吸收液的回收再利用,装置如图所示,则

①工作一段时间后,阴极区溶液的pH______(填“增大”“减小”或“不变”);
②写出阳极的电极反应式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]化合物M是一种香料,A与D是常见的有机化工原料,按下列路线合成化合物M: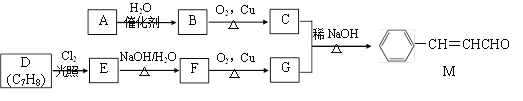
已知以下信息:
①A的相对分子质量为28
回答下列问题:
(1)A的名称是___________,D的结构简式是___________。
(2)A生成B的反应类型为________,C中官能团名称为___________。
(3)E生成F的的化学方程式为___________。
(4)下列关于G的说法正确的是___________。(填标号)
a.属于芳香烃
b.可与FeCl3溶液反应显紫色
c.可与新制的Cu(OH)2共热生成红色沉淀
d.G分子中最多有14个原子共平面
(5)化合物M的同系物N比M的相对分子质量大14,N的同分异构体中同时满足下列条件的共有________种(不考虑立体异构)。
①与化合物M含有相同的官能团;②苯环上有两个取代基
(6)参照上述合成路线,化合物X与Y以物质的量之比2:1反应可得到化合物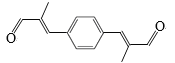 ,X的结构简式为________,Y的结构简式为________。
,X的结构简式为________,Y的结构简式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com