
【题目】已知锌跟浓硫酸反应生成SO2,跟稀硫酸反应生成H2,32.5克的锌与50 mL 18.4 mol/L浓硫酸充分反应,锌完全溶解,同时收集到标准状况下的气体VL。将反应后的溶液稀释到500mL,测得溶液中氢离子的浓度为0.08 mol/L。
(1)反应过程中消耗的H2SO4的物质的量是________。
(2)气体的成分是______,V为______。
(3)反应过程中转移的电子的物质的量是________。
(4)另取相同浓硫酸,向其中改加铁粉,若逐渐加入a克铁粉,同时加热,最终数据均同上,则a=_____。
【答案】0.9 mol 二氧化硫和氢气 V=11.2 1mol 28
【解析】
(1)原硫酸的物质的量=50mL×18.4mol/L=0.92mol;
反应后,氢离子浓度为0.08mol/L,则硫酸的浓度为0.04mol/L;
反应后硫酸的物质的量为0.04mol/L×500mL=0.02mol;
则反应消耗的硫酸的物质的量为0.92mol-0.02mol=0.9mol;
(2)假设生成二氧化硫的物质的量为x,生成氢气的物质的量为y,根据化学方程式Zn+2H2SO4=ZnSO4+SO2↑+H2O,Zn+H2SO4=ZnSO4+H2↑;可得
![]() ,解得
,解得![]() ;
;
则生成气体的体积为(0.4+0.1)×22.4=11.2L;
(3)反应共消耗Zn的物质的量为32.5÷65=0.5mol,反应中Zn被氧化为Zn2+,故反应过程中转移的电子的物质的量是1mol;
(4)另取相同浓硫酸,向其中改加铁粉,虽然浓硫酸的氧化性很强,开始会将Fe氧化到+3价,但是随着浓度变稀,Fe3+会和Fe反应生成Fe2+,因此溶液中最终均为+2价的亚铁离子,与溶液中均为+2的锌离子相似,则最终数据相同,加入Fe的物质的量与Zn的物质的量相同,均为0.5mol,其质量为0.5mol×56g/mol=28g。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】化学概念在逻辑上存在如图关系,对下列概念的说法正确的是( )

A. 化合物与氧化物属于交叉关系
B. 单质与非电解质属于包含关系
C. 溶液与分散系属于并列关系
D. 化合物与电解质属于包含关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知两种常见金属A(地壳中含量第二的金属)、B(红色金属)分别与两种酸X、Y发生反应,其转化关系如图所示,其中D为红棕色气体。
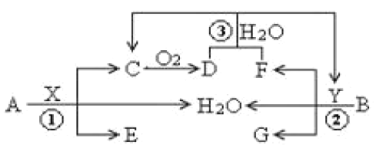
回答以下问题:
(1)反应③的离子反应方程式为___;
(2)6.4gB与过量X溶液(8mol /L、60mL)充分反应后,生成的还原产物有C、D,反应后溶液中所含X为n mol ,此时溶液中所含X的阴离子的物质的量为___mol。
(3)常温下A与Y的稀溶液能发生反应生成盐W,关于固体W的转化关系如图所示(无关物质已略去)。其中N是红棕色的化合物。

①M由两种化合物组成,其中含有F;将M通入BaCl2溶液,实验现象是___。
②若经反应I得到16 g固体N,产生的气体M恰好被0.3L1mol·L-1 NaOH溶液完全吸收得溶液1,则反应Ⅳ中发生反应的离子方程式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氢呋喃 (THF)常用于药物合成,结构如下图,下列关于该化合物的说法错误的是
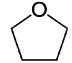
A.二氯代物有五种
B.与丁醛互为同分异构体
C.所有碳原子不能处于同一平面
D.1mol呋喃(![]() )生成1 mol 四氢呋喃需要2 mol H2
)生成1 mol 四氢呋喃需要2 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅在无机非金属材料中,扮演着主要角色,请利用相关知识回答下列问题:
(1)硅有非常重要的用途,请写出其中的一种:_________________________________。
(2)古瓷中所用颜料成分一直是个谜,近年来科学家才得知大多为硅酸盐,如蓝紫色的硅酸铜钡(BaCuSi2Ox,铜为+2价),下列关于硅酸铜钡的说法不正确的是________。
A.可用氧化物形式表示为BaO·CuO·2SiO2
B.性质稳定,不易脱色
C.x等于6
D.易溶解于强酸和强碱
(3)工业上提纯硅有多种路线,其中一种工艺流程示意图如下:

①在电弧炉中发生的反应需要在高温条件进行,写出该反应化学方程式:________________。
②SiCl4极易水解,在空气中生成烟尘和白雾,推测书写其水解的化学方程式为____________________。
③在流化床反应的产物中,除SiCl4外,还有SiHCl3、SiH2Cl2、SiH3Cl、FeCl3等,有关物质的沸点数据如下表,分离SiCl4和其他杂质的方法为________。
物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某NaOH样品中含有少量Na2CO3、NaHCO3和H2O,经分析测定,其中含NaOH83.4%(质量分数,下同), NaHCO3 8.8%,Na2CO3 6.4%,H2O 1.4%。将此样品若干克投入到49克21%的稀硫酸中,待反应完全后,需加入20克9.0%的NaOH溶液方能恰好中和。则蒸发中和后的溶液可得固体质量接近于
A. 25 B. 20 C. 15 D. 10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Be(OH)2是两性的,跟强酸反应时生成Be2+,跟强碱反应时生成BeO22—。现有三份等物质的量浓度、等体积的BeCl2、MgCl2、AlCl3溶液(配制时均加入少量盐酸),现将一定浓度的NaOH溶液分别滴入三种溶液中至过量,NaOH溶液的体积x(mL)与生成沉淀的物质的量y(mol)的关系如图所示,则与BeCl2、MgCl2、AlCl3三种溶液对应的图像正确的是( )
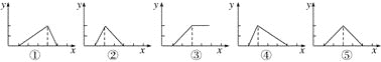
A. ⑤③① B. ②③④ C. ③⑤④ D. ③②①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g) ![]() 2Z(g)+W(s) ΔH<0,下列叙述正确的是 ( )
2Z(g)+W(s) ΔH<0,下列叙述正确的是 ( )
A. 平衡常数K值越大,X的转化率越大
B. 达到平衡时,反应速率v正(X)=2v逆(Z)
C. 达到平衡后降低温度,正向反应速率减小的倍数大于逆向反应速率减小的倍数
D. 达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A. 标况下,224 L H2O含有的分子数为10NA
B. 1 mol任何气体所含的原子数均为NA
C. 28 g CO所含的分子数为NA
D. 标况下,NA个分子的体积为22.4 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com