
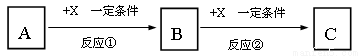
£Ø12·Ö£©A”¢B”¢C”¢X¾łĪŖ֊ѧ³£¼ūµÄ“æ¾»Īļ£¬ĖüĆĒÖ®¼äÓŠČēĻĀ×Ŗ»Æ¹ŲĻµ£Øø±²śĪļŅŃĀŌČ„£©”£
ŹŌ»Ų“š£ŗ
£Ø1£©ČōXŹĒĒæŃõ»ÆŠŌµ„ÖŹ£¬ŌņA²»æÉÄÜŹĒ________________”£
A S B N2 C Na D£®Mg E£®Al
£Ø2£©ČōXŹĒ½šŹōµ„ÖŹ£¬ĻņCµÄĖ®ČÜŅŗÖŠµĪ¼ÓAgNO3ČÜŅŗ£¬²śÉś²»ČÜÓŚĻ”HNO3µÄ°×É«³Įµķ£¬ŌņBµÄ»ÆѧŹ½ĪŖ_________£»CČÜŅŗŌŚÖü“ꏱӦ¼ÓČėÉŁĮæX£¬ĄķÓÉŹĒ________________________£¬£ØÓƱŲŅŖµÄĪÄ×ÖŗĶĄė×Ó·½³ĢŹ½±ķŹ¾£©¼ģŃé“ĖCČÜŅŗÖŠ½šŹōŌŖĖŲ¼ŪĢ¬µÄ²Ł×÷·½·ØŹĒ____________________________”£
£Ø3£©ČōA”¢B”¢CĪŖŗ¬ÓŠ½šŹōŌŖĖŲµÄĪŽ»ś»ÆŗĻĪļ£¬XĪŖĒæĖį»ņĒæ¼ī£¬AČÜŅŗÓėCČÜŅŗ·“Ӧɜ³ÉB”£·“Ó¦¢ŁµÄĄė×Ó·½³ĢŹ½æÉÄÜĪŖ____ ___________»ņ____________________________”£
£Ø1£©D”¢E£Ø2·Ö£©£Ø2£©FeCl3£»£Ø2·Ö£©2Fe3++Fe£½3Fe2+ £¬·ĄÖ¹Fe2+±»Ńõ»Æ£Ø2·Ö£©
ÓĆŹŌ¹ÜȔɣĮæCČÜŅŗ£¬µĪ¼ÓKSCNČÜŅŗ£¬ĪŽŃÕÉ«±ä»Æ£¬ŌŁµĪ¼ÓĀČĖ®£Ø»ņĻõĖį£©£¬ČÜŅŗ³ŹŃŖŗģÉ«£¬Ö¤Ć÷ŌČÜŅŗÖŠÓŠFe2+“ęŌŚ£»£Ø2·Ö£©
£Ø3£© Al3+ +3OHØD£½Al(OH)3”ż£Ø2·Ö£©AlO2-+H++H2O= Al(OH)3”ż£Ø2·Ö£©”£
”¾½āĪö”æ
ŹŌĢā·ÖĪö£ŗ£Ø1£©ČōXŹĒĒæŃõ»ÆŠŌµ„ÖŹ£¬A£®SŗĶŃõĘų·“Ӧɜ³É¶žŃõ»ÆĮņ£¬¶žŃõ»ÆĮņŗĶŃõĘų·“Ӧɜ³ÉČżŃõ»ÆĮņ£¬ĖłŅŌ·ūŗĻ×Ŗ»Æ¹ŲĻµ£» ÕżČ·B£®N2ŗĶŃõĘų·“Ӧɜ³ÉŅ»Ńõ»ÆµŖ£¬Ņ»Ńõ»ÆµŖŗĶŃõĘų·“Ӧɜ³É¶žŃõ»ÆµŖ£¬ĖłŅŌ·ūŗĻ×Ŗ»Æ¹ŲĻµ£»ÕżČ·£»C£®NaŗĶŃõĘų·“Ӧɜ³ÉŃõ»ÆÄĘ£¬Ńõ»ÆÄĘŗĶŃõĘų·“Ӧɜ³É¹żŃõ»ÆÄĘ£¬ĖłŅŌ·ūŗĻ×Ŗ»Æ¹ŲĻµ£» ÕżČ·£»D£®MgŗĶŃõĘų·“Ӧɜ³ÉŃõ»ÆĆ¾£¬Ńõ»ÆĆ¾ŗĶŃõĘų²»·“Ó¦£¬ĖłŅŌ²»·ūŗĻ×Ŗ»Æ¹ŲĻµ£»“ķĪó£»E£®AlŗĶŃõĘų·“Ӧɜ³ÉŃõ»ÆĀĮ£¬Ńõ»ÆĀĮŗĶŃõĘų²»·“Ó¦£¬ĖłŅŌ²»·ūŗĻ×Ŗ»Æ¹ŲĻµ£¬“ķĪ󔣹ŹŃ”D”¢E£»£Ø2£©ČōXŹĒ½šŹōµ„ÖŹ£¬ĻņCµÄĖ®ČÜŅŗÖŠµĪ¼ÓAgNO3ČÜŅŗ£¬²śÉś²»ČÜÓŚĻ”HNO3µÄ°×É«³Įµķ£¬ŌņCÖŠŗ¬ÓŠĀČĄė×Ó£¬ĒŅXŹĒ±ä¼Ū½šŹō£¬ŌņĪŖĢś£¬ĖłŅŌCŹĒĀČ»ÆŃĒĢś£¬BŹĒĀČ»ÆĢś£¬AŹĒĀČĘų£»CĀČ»ÆŃĒĢśČÜŅŗŌŚÖü“ꏱӦ¼ÓČėÉŁĮæX£¬ĄķÓÉŹĒFe2+ČŻŅ×±»æÕĘųÖŠµÄŃõĘųŃõ»ÆĪŖFe3+.¼ÓČėFe·ŪÄæµÄ¾ĶæÉŅŌ·¢Éś·“Ó¦£ŗ2Fe3++Fe£½3Fe2+ £¬Ņņ“ĖæÉŅŌ·ĄÖ¹Fe2+±»Ńõ»Æ£»¼ģŃé“ĖCČÜŅŗÖŠ½šŹōŌŖĖŲ¼ŪĢ¬µÄ²Ł×÷·½·ØŹĒÓĆŹŌ¹ÜȔɣĮæCČÜŅŗ£¬µĪ¼ÓKSCNČÜŅŗ£¬ĪŽŃÕÉ«±ä»Æ£¬ŌŁµĪ¼ÓĀČĖ®£Ø»ņĻõĖį£©£¬ČÜŅŗ³ŹŃŖŗģÉ«£¬Ö¤Ć÷ŌČÜŅŗÖŠÓŠFe2+“ęŌŚ£»£Ø3£©ČōXĪŖĒæĖį£¬ŌņAŹĒNaAlO2,”¢BŹĒAl(OH)3;CŹĒAlCl3,£»·“Ó¦¢ŁµÄĄė×Ó·½³ĢŹ½æÉÄÜĪŖAlO2-+H++H2O= Al(OH)3”ż; ČōXĪŖĒæĖį£¬ŌņAŹĒAlCl3£»BŹĒAl(OH)3;CŹĒ,NaAlO2£»·“Ó¦¢ŁµÄĄė×Ó·½³ĢŹ½æÉÄÜĪŖAl3+ +3OHØD£½Al(OH)3”ż”£
æ¼µć£ŗæ¼²éĪļÖŹµÄĶʶĻ£¬Ö÷ŅŖ°üĄØĪļÖŹµÄŃõ»ÆŠŌ”¢»¹ŌŠŌ”¢ŃĪµÄĖ®½ā”¢ĪļÖŹµÄ±£“ę”¢Ąė×ӵļģŃ锢Ąė×Ó·½³ĢŹ½µÄŹéŠ“µÄÖŖŹ¶”£


 æŖŠÄĶÜדŌŖ²āŹŌ¾ķĻµĮŠ“š°ø
æŖŠÄĶÜדŌŖ²āŹŌ¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015½ģ¹ć¶«Ź”֊ɽŹŠøßČżÉĻѧʌµŚ¶ž“ĪÄ£Äāæ¼ŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
°ŃĀČĘųĶØČėĻĀĮŠø÷ĪļÖŹµÄČÜŅŗÖŠ£¬ŅõĄė×ÓŗĶŃōĄė×Ó¶¼Äܱ»Ńõ»ÆµÄŹĒ£Ø £©
A£®NaOH B£®Na2SO3 C£®FeBr2 D£®FeSO4
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015½ģ¹ć¶«Ź”Ęߊ£øßČżÉĻѧʌµŚŅ»“ĪĮŖæ¼Ąķ×Ū»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠĖµ·ØÖŠÕżČ·µÄŹĒ
A£®0.1mol/L (NH4)2SO4ČÜŅŗÖŠ£ŗc(SO42”Ŗ) > c(NH4+) > c(H+) > c(OH£)
B£®pH=4µÄ“×ĖįĻ”ŹĶl0±¶£¬ČÜŅŗÖŠc£ØCH3COOH£©”¢c£ØOH©£©¾ł¼õŠ”
C£®³£ĪĀĻĀĻņCH3COONaČÜŅŗÖŠ¼ÓČėŹŹĮæCH3COOHČÜŅŗ£¬Ź¹»ģŗĻŅŗµÄpH=7£¬Ōņ»ģŗĻŅŗÖŠc(Na+)£½c(CH3COO”Ŗ)
D£®µČÅØ¶ČµÄČõĖįHAČÜŅŗŗĶNaOHČÜŅŗµČĢå»ż»ģŗĻ£¬ĖłµĆ»ģŗĻŅŗĻŌ¼īŠŌ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015½ģɽĪ÷Ź”øßČżÉĻŃ§ĘŚĘŚÖŠæ¼ŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
æĘѧ¼Ņ“ӻƷŹ³§Éś²śµÄ(NH4)2SO4ÖŠ¼ģ³ö»ÆѧŹ½ĪŖN4H4(SO4)2µÄĪļÖŹ£¬øĆĪļÖŹµÄ¾§ĢåÖŠŗ¬ÓŠSO42-ŗĶN4H44+Į½ÖÖĄė×Ó£¬µ±N4H44+Óöµ½¼īŠŌČÜŅŗŹ±£¬»įÉś³ÉN4·Ö×Ó”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A£®14N”¢N4ÓėN2»„ĪŖĶ¬Ī»ĖŲ
B£®N4H4(SO4)2µÄµēĄė·½³ĢŹ½ĪŖN4H4(SO4)2 N4H44+£«2 SO42-
N4H44+£«2 SO42-
C£®N4H4(SO4)2²»ÄÜÓė²ŻÄ¾»Ņ”¢K3PO4µČ»Æ·Ź»ģŗĻŹ©ÓĆ
D£®N4H4(SO4)2ÖŠÖ»ŗ¬ÓŠ¹²¼Ū¼ü£¬²»ŗ¬Ąė×Ó¼ü
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015½ģɽĪ÷Ź”øßČżÉĻŃ§ĘŚĘŚÖŠæ¼ŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
²ĖĘ×ÖŠ¼ĒŌŲ£ŗŗÓĻŗ²»ŅĖÓėĪ÷ŗģŹĮĶ¬Ź³”£Ö÷ŅŖŌŅņŹĒŗÓĻŗÖŠŗ¬ÓŠĪå¼ŪÉ飬Ī÷ŗģŹĮÖŠŗ¬ÓŠ±Č½Ļ¶ąµÄĪ¬ÉśĖŲC£¬Į½ÕßĶ¬Ź³Ź±»įÉś³ÉÓŠ¶¾µÄ£«3¼ŪÉ锣ĻĀĮŠĖµ·ØÖŠÕżČ·µÄŹĒ
A£®ŌŚøĆ·“Ó¦ÖŠĪ¬ÉśĖŲC×÷“߻ƼĮ
B£®ŅņĪŖŗÓĻŗÖŠŗ¬ÓŠÉéŌŖĖŲ£¬ĖłŅŌ²»ÄÜŹ³ÓĆ
C£®ÅųĖŖŹĒÉéµÄŃõ»ÆĪļ£¬ÓÉÉĻŹöŠÅĻ¢æÉĶĘÖŖÅųĖŖÖŠŗ¬ÓŠµÄÉéæÉÄÜŹĒ£«3¼ŪÉé
D£®ÉĻŹö·“Ó¦ÖŠĪ¬ÉśĖŲC×÷Ńõ»Æ¼Į
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015½ģɽ¶«Ź”øßČżÉĻѧʌµŚ¶ž“ĪŌĀæ¼ĮŖæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
 ĻņFeI2”¢FeBr2µÄ»ģŗĻČÜŅŗÖŠĶØČėŹŹĮæĀČĘų£¬ČÜŅŗ֊ijŠ©Ąė×ÓµÄĪļÖŹµÄĮæ±ä»ÆČēĶ¼ĖłŹ¾”£ŌņĻĀĮŠÓŠ¹ŲĖµ·ØÖŠ²»ÕżČ·µÄ
ĻņFeI2”¢FeBr2µÄ»ģŗĻČÜŅŗÖŠĶØČėŹŹĮæĀČĘų£¬ČÜŅŗ֊ijŠ©Ąė×ÓµÄĪļÖŹµÄĮæ±ä»ÆČēĶ¼ĖłŹ¾”£ŌņĻĀĮŠÓŠ¹ŲĖµ·ØÖŠ²»ÕżČ·µÄ
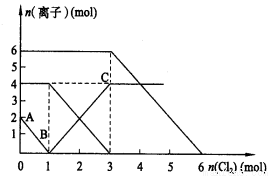
A£®»¹ŌŠŌ£ŗI- >Fe2+ > Br-
B£®Ō»ģŗĻČÜŅŗÖŠFeBr2µÄĪļÖŹµÄĮæĪŖ6mol
C£®µ±ĶØČė2molCl2Ź±£¬ČÜŅŗÖŠŅŃ·¢ÉśµÄĄė×Ó·“Ó¦æɱķŹ¾ĪŖ£ŗ2Fe2++2I-+2Cl2===2Fe3++I2+4Cl-
D£®ŌČÜŅŗÖŠ£ŗn£ØFe2+£©£ŗn£ØI-£©£ŗn£ØBr-£©=2£ŗ1£ŗ3
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015½ģɽ¶«Ź”øßČżÉĻѧʌµŚ¶ž“ĪŌĀæ¼ĮŖæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ijČÜŅŗÖŠæÉÄÜ“ęŌŚBr£”¢CO32£”¢SO32£”¢Al3+”¢I£”¢Mg2+”¢Na+µČ7ÖÖĄė×ÓÖŠµÄij¼øÖÖ”£ĻÖČ”øĆČÜŅŗ½ųŠŠŹµŃ飬µĆµ½ČēĻĀĻÖĻó£ŗ ¢ŁĻņČÜŅŗÖŠµĪ¼Ó×ćĮæĀČĖ®ŗó£¬ČÜŅŗ±ä³Č»ĘÉ«£¬ĒŅÓŠĪŽÉ«ĘųÅŻĆ°³ö ¢ŚĻņĖłµĆ³ČÉ«ČÜŅŗÖŠ¼ÓČė×ćĮæBaCl2ČÜŅŗ£¬ĪŽ³ĮµķÉś³É ¢ŪĻņĖłµĆČÜŅŗÖŠ¼ĢŠųµĪ¼Óµķ·ŪČÜŅŗ£¬ČÜŅŗ²»±äĄ¶É«”£¾Ż“ĖæÉŅŌĶʶĻ£ŗøĆČÜŅŗÖŠæĻ¶Ø²»“ęŌŚµÄĄė×Ó×éŹĒ
A£®Al3+ Mg2+ I£ SO32£ B£®Mg2+ Na+ CO32£ I£
C£®Al3+ Na+ SO32£ I£ D£®Na+ CO32£ Br£ I£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015½ģɽ¶«Ź”׎³ĒŹŠøßČż10ŌĀŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ÓÉŗ£Ė®ÖʱøĪŽĖ®ĀČ»ÆĆ¾£¬Ö÷ŅŖÓŠŅŌĻĀ²½Öč£ŗ¢ŁŌŚŅ»¶ØĢõ¼žĻĀĶŃĖ®øÉŌļ£»¢Ś¼ÓŹģŹÆ»Ņ£»
¢Ū¼ÓŃĪĖį£»¢Ü¹żĀĖ£»¢ŻÅØĖõ½į¾§”£ĘäĻČŗóĖ³ŠņÕżČ·µÄŹĒ
A£®¢Ś¢Ü¢Ū¢Ż¢Ł B£®¢Ū¢Ś¢Ü¢Ł¢Ż C£®¢Ū¢Ü¢Ś¢Ż¢Ł D£®¢Ś¢Ü¢Ż¢Ū¢Ł
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015½ģɽ¶«Ź”øßČżÉĻѧʌµŚŅ»“ĪÖŹĮæ¼ģ²ā»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
£Ø14·Ö£©I”¢ĆŗĢæÖŠŅŌFeS2ŠĪŹ½“ęŌŚµÄĮņ£¬ŌŚÓŠĖ®ŗĶæÕĘų¼°ŌŚĶŃĮņĪ¢ÉśĪļ“ęŌŚĻĀ·¢ÉśÉśĪļŃõ»Æ»¹Ō·“Ó¦£¬ÓŠ¹Ų·“Ó¦µÄĄė×Ó·½³ĢŹ½ŅĄ“ĪĪŖ£ŗ
¢Ł2FeS2+7O2+2H2O 4H++2Fe2++4SO42- £» ¢ŚFe2++O2+H+
4H++2Fe2++4SO42- £» ¢ŚFe2++O2+H+ Fe3++____________£»
Fe3++____________£»
¢ŪFeS2+2Fe3+ 3Fe2++2S£» ¢Ü2S+3O2+2H2O
3Fe2++2S£» ¢Ü2S+3O2+2H2O 4H++2SO42£”£
4H++2SO42£”£
ŅŃÖŖ£ŗFeS2ÖŠµÄĮņŌŖĖŲĪŖ£1¼Ū”£
»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©øł¾ŻÖŹĮæŹŲŗć¶ØĀÉŗĶµēŗÉŹŲŗć¶ØĀÉ£¬½«ÉĻŹö¢ŚĄė×Ó·½³ĢŹ½ÅäĘ½²¢²¹³äĶźÕū”£
£Ø2£©·“Ó¦¢ŪµÄ»¹Ō¼ĮŹĒ__________________”£
£Ø3£©¹Ū²ģÉĻŹö·“Ó¦£¬ĮņŌŖĖŲ×īÖÕ×Ŗ»ÆĪŖ____________“ÓĆŗĢæÖŠ·ÖĄė³öĄ“
II”¢ŌŚµķ·ŪKIČÜŅŗÖŠ£¬µĪČėÉŁĮæNaClOČÜŅŗ£¬ČÜŅŗĮ¢¼“±äĄ¶£¬ÓŠ¹Ų·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹĒ___________”£ ŌŚÉĻŹöĄ¶É«ČÜŅŗÖŠ£¬¼ĢŠųµĪ¼Ó×ćĮæµÄNaClOČÜŅŗ£¬Ą¶É«Öš½„ĻūŹ§£¬ÓŠ¹Ų·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹĒ___________”££ØĢįŹ¾£ŗµāŌŖĖŲ±»Ńõ»Æ³ÉIO3”Ŗ£©“ÓŅŌÉĻŹµŃéæÉÖŖ£¬ClO”Ŗ”¢I2”¢IO3”ŖµÄŃõ»ÆŠŌÓÉĒæµ½ČõµÄĖ³ŠņŹĒ ”£
III”¢¹¤ŅµÉĻÓĆ»ĘĶæó£Ø CuFeS2£©Ņ±Į¶Ķ£¬ø±²śĘ·ÖŠŅ²ÓŠSO2 £¬Ņ±Į¶ĶµÄ·“Ó¦ĪŖ8CuFeS2+ 21O2  8Cu+4FeO+2Fe2O3+16SO2.ČōCuFeS2ÖŠ Fe µÄ»ÆŗĻ¼ŪĪŖ£«2 £¬·“Ó¦ÖŠ±»»¹ŌµÄŌŖĖŲŹĒ £ØĢīŌŖĖŲ·ūŗÅ£©”£µ±Éś³É0.8 molĶŹ±£¬“Ė·“Ó¦×ŖŅʵĵē×ÓŹżÄæŹĒ___________________”£
8Cu+4FeO+2Fe2O3+16SO2.ČōCuFeS2ÖŠ Fe µÄ»ÆŗĻ¼ŪĪŖ£«2 £¬·“Ó¦ÖŠ±»»¹ŌµÄŌŖĖŲŹĒ £ØĢīŌŖĖŲ·ūŗÅ£©”£µ±Éś³É0.8 molĶŹ±£¬“Ė·“Ó¦×ŖŅʵĵē×ÓŹżÄæŹĒ___________________”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com