
 其中氧化剂是MnO2,氧化产物是Cl2,氧化剂和还原剂物质的量之比是1:2.
其中氧化剂是MnO2,氧化产物是Cl2,氧化剂和还原剂物质的量之比是1:2.分析 (1)MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O改写为离子方程式时氧化物、单质、水、难溶物质要写成化学式的形式,则其离子方程式为:MnO2+4H ++2 Cl-(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)双线桥分析氧化还原反应是基础,只要结合元素化合价的变化和电子守恒就可以了;该反应中,MnO2→MnCl2,Mn元素由+4价→+2价,得2个电子,所以MnO2是氧化剂;HCl(浓)→Cl2,Cl元素由-1价→0价,失电子,所以 HCl是还原剂;HCl被氧化生成的氯气为氧化产物;氧化剂和还原剂物质的量之比是 1:2;
(3)依据方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,反应中每生成1mol氯气,有2mol氯化氢中的氯从-1价升高为氯气中的0价的氯,转移2mol电子,据此解答;
解答 解:(1)MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O改写为离子方程式时氧化物、单质、水、难溶物质要写成化学式的形式,则其离子方程式为:MnO2+4H ++2 Cl-(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,故答案为:MnO2+4H ++2 Cl-(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)Mn元素的化合价从+4价降为+2价,Cl元素从-1价升高为0价,可通过双线桥分析此氧化还原反应, ,;其中氧化剂是二氧化锰,氧化产物是氯气,氧化剂和还原剂物质的量之比是 1:2,
,;其中氧化剂是二氧化锰,氧化产物是氯气,氧化剂和还原剂物质的量之比是 1:2,
故答案为: ;MnO2; Cl2;1:2;
;MnO2; Cl2;1:2;
(3)依据方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,反应中每生成1mol氯气,有2mol氯化氢中的氯从-1价升高为氯气中的0价的氯,转移2mol电子,则生成标准状况下有33.6L 氯气,物质的量为$\frac{33.6L}{22.4L/mol}$=1.5mol,转移电子数为3mol,个数为3 NA;
故答案为:3 NA.
点评 本题考查了离子方程式的书写、氧化还原反应电子转移数目计算,明确离子方程式书写方法是解题关键,题目难度不大.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+Mg2+ CO32-Cl- | B. | Fe3+Cl- Na+H+ | ||
| C. | H+ Ag+ NO3- NH4+ | D. | CO32-H+Na+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
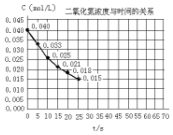 二氧化氮在加热条件下能够分解成一氧化氮和氧气.该反应进行到45秒时,达到平衡(NO2浓度约为0.0125mol/L).图中的曲线表示二氧化氮分解反应在前25秒内的反应进程.
二氧化氮在加热条件下能够分解成一氧化氮和氧气.该反应进行到45秒时,达到平衡(NO2浓度约为0.0125mol/L).图中的曲线表示二氧化氮分解反应在前25秒内的反应进程.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO3溶液和NaHCO3溶液反应:H2SO3+2HCO3-=SO32-+2CO2↑+2H2O | |
| B. | 控制pH为9~10,用NaClO溶液将含NaCN的废水中的CN-氧化为两种无污染的气体:2CN-+5ClO-+2H+=N2↑+2CO2↑+5Cl-+H2O | |
| C. | 已知硫酸铅难溶于水,也难溶于硝酸,却可溶于醋酸铵溶液中,形成无色溶液.当Pb(CH3COO)2溶液中通入H2S气体时有黑色沉淀生成:Pb2++H2S=PbS↓+2H+ | |
| D. | CuSO4溶液与过量浓氨水反应:Cu2++4NH3•H2O=[Cu(NH3)4]2++4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高 | B. | 降 低 | C. | 不变 | D. | 无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com