
| A. | 没有用蒸馏水洗烧杯2-3次,并将洗液移入容量瓶中 | |
| B. | 容量瓶刚用蒸馏水洗净,没有烘干 | |
| C. | 定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切 | |
| D. | 定容时俯视刻度线 |
分析 分析操作对溶质的物质的量n和溶液体积V的影响,依据c=$\frac{n}{V}$分析,凡是使n偏小或者使V偏大的操作都会使溶液浓度偏低,凡是使n偏达或者使V偏小的操作都会使溶液浓度偏高,以此解答该题.
解答 解:A.没有用蒸馏水洗烧杯2-3次,并将洗液移入容量瓶中,导致溶质的物质的量偏小,则浓度偏低,故A错误;
B.容量瓶需要加热蒸馏水,无需烘干,故B错误;
C.液面略高于刻度线,导致浓度偏低,再吸出少量水使液面凹面与刻度线相切不能改变浓度,故C错误;
D.定容时俯视刻度线,体积偏小,浓度偏大,故D正确.
故选D.
点评 本题考查了配制一定物质的量浓度的溶液方法及误差分析,为高频考点,题目难度不大,注意掌握配制一定物质的量浓度的溶液方法,明确误差分析的方法与技巧.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B3N3H6和苯是等电子体,B3N3H6分子中所有原子均不在同一平面上 | |
| B. | NO3-和CO32-是等电子体,均为平面正三角形结构 | |
| C. | H3O+和PCl3是等电子体,均为三角锥形 | |
| D. | CH4和NH4+是等电子体,均为正四面体形,键角均为60° |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

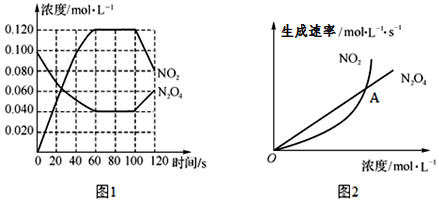
| A. | (2)(5) | B. | (1)(6) | C. | (4)(7) | D. | (3)(4) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2>BrO3->ClO3->HIO3 | B. | ClO3->BrO3->HIO3>Cl2 | ||
| C. | BrO3->Cl2>ClO3->HIO3 | D. | BrO3->ClO3->Cl2>HIO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
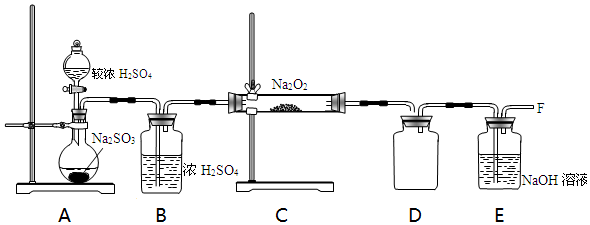
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用明矾净化饮用水 | |
| B. | 用石膏或盐卤点制豆腐 | |
| C. | 在CuSO4溶液中逐滴加入烧碱溶液出现蓝色沉淀 | |
| D. | 用手电筒照向夜空中会出现一条光柱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
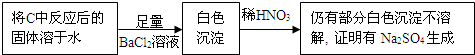
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量吸收液于试管中滴加BaCl2溶液至过量 | 白色浑浊 | 吸收液中存在SO32-和SO42- |
| 取步骤I中白色沉淀于试管中,加入过量的稀盐酸 | 固体部分溶解,产生气泡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com