
【题目】如图是某研究性学习小组设计制取氯气并以氯气为反应物进行特定反应的装置。

(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关反应的化学方程式为_______________________。装置B中饱和食盐水的作用是____________________。要将C装置接入B和D之间,正确的接法是a→_________→________→d。
(2)实验开始先点燃A处的酒精灯,打开活塞K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C装置后进入D,D装置内盛有炭粉,发生氧化还原反应,生成CO2和HCl(g),发生反应的化学方程式为________________。为了使C装置发挥更好的作用,可向烧杯中加入浓硫酸,加入浓硫酸的作用是____________________。
(3)D处反应完毕后,关闭弹簧夹K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是_____________________________________,B的作用是__________________________。
【答案】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 除去Cl2中的HCl c b 2Cl2+C+2H2O
MnCl2+Cl2↑+2H2O 除去Cl2中的HCl c b 2Cl2+C+2H2O![]() 4HCl+CO2 加入的浓硫酸溶于水放出大量的热,有利于试管中的水变为水蒸气,从而提供足量的水蒸气供D中反应需要 装置B内黄绿色气体,液面下降,长颈漏斗中液体上升 同时不使Cl2外泄,从而在B装置中贮存了少量Cl2,避免Cl2对环境造成污染
4HCl+CO2 加入的浓硫酸溶于水放出大量的热,有利于试管中的水变为水蒸气,从而提供足量的水蒸气供D中反应需要 装置B内黄绿色气体,液面下降,长颈漏斗中液体上升 同时不使Cl2外泄,从而在B装置中贮存了少量Cl2,避免Cl2对环境造成污染
【解析】
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,反应生成氯化锰、氯气和水,氯气中有HCl和水蒸气杂质,因此装置B中饱和食盐水的作用是除掉HCl杂质,氯气再流速的过程中要代入水蒸气,因此要长进短出;
(2)Cl2通过C装置后进入D,D装置内盛有炭粉,发生氧化还原反应,生成CO2和HCl(g),根据信息得出反应的化学方程式。为了使C装置发挥更好的作用,可向烧杯中加入浓硫酸,放出大量的热量,有利于试管中的水变为水蒸气,从而提供足量的水蒸气供D中反应需要;
(3)由于余热的作用,A处仍有少量Cl2产生,氯气进入到B装置中,氯气不会溶解在饱和氯化钠溶液中,因此B中的现象是装置B内黄绿色气体,液面下降,长颈漏斗中液体上升,B的作用是同时不使Cl2外泄,从而在B装置中贮存了少量Cl2,避免Cl2对环境造成污染。
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关反应的化学方程式为MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,氯气中有HCl和水蒸气杂质,因此装置B中饱和食盐水的作用是除掉HCl杂质,氯气再流速的过程中要代入水蒸气,因此要长进短出,正确的接法是a→c→b→d;
MnCl2+Cl2↑+2H2O,氯气中有HCl和水蒸气杂质,因此装置B中饱和食盐水的作用是除掉HCl杂质,氯气再流速的过程中要代入水蒸气,因此要长进短出,正确的接法是a→c→b→d;
(2)Cl2通过C装置后进入D,D装置内盛有炭粉,发生氧化还原反应,生成CO2和HCl(g),根据信息得出反应的化学方程式为2Cl2+C+2H2O![]() 4HCl+CO2;为了使C装置发挥更好的作用,可向烧杯中加入浓硫酸,放出大量的热量,因此加入浓硫酸的作用是加入的浓硫酸溶于水放出大量的热,有利于试管中的水变为水蒸气,从而提供足量的水蒸气供D中反应需要;
4HCl+CO2;为了使C装置发挥更好的作用,可向烧杯中加入浓硫酸,放出大量的热量,因此加入浓硫酸的作用是加入的浓硫酸溶于水放出大量的热,有利于试管中的水变为水蒸气,从而提供足量的水蒸气供D中反应需要;
(3)由于余热的作用,A处仍有少量Cl2产生,氯气进入到B装置中,氯气不会溶解在饱和氯化钠溶液中,因此B中的现象是装置B内黄绿色气体,液面下降,长颈漏斗中液体上升,B的作用是同时不使Cl2外泄,从而在B装置中贮存了少量Cl2,避免Cl2对环境造成污染。


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 常温常压下,8g甲烷中含C-H键数目为0.4NA
B. 标准状况下,11.2LSO3中含分子数目为0.5NA
C. 1L0.1mol/LNH4NO3溶液中含氧原子数目为0.3NA
D. 7.8gNa2O2与足量CO2完全反应转移电子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是同周期主族元素,Y的最外层电子数是X次外层电子数的3倍,四种元素与锂组成的盐是一种新型的锂离子电池的电解质(结构如图,箭头表示配位键)。下列说法不正确的是( )

A.W的非金属性比Y的强
B.该物质中X原子满足8电子稳定结构
C.该物质中含离子键和共价键
D.Z的氧化物都易溶于水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物的转化过程如图所示。下列分析合理的是
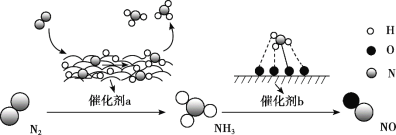
A. 催化剂a表面发生了极性共价键的断裂和形成
B. N2与H2反应生成NH3的原子利用率为100%
C. 在催化剂b表面形成氮氧键时,不涉及电子转移
D. 催化剂a、b能提高反应的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.某盐是一种重要的化工原料,在印染、制革、木材和农业等领域有重要用途,其溶液可能含有NH4+、Al3+、SO42-、Fe2+、Cl-等若干种离子,某同学设计并完成了如下实验:

根据以上的实验操作与现象,该同学得出的结论不正确的是( )
A.试样中肯定有NH4+、SO42-和Fe2+
B.试样中一定没有Al3+
C.若气体甲在标准状况下体积为0.448 L,沉淀丙和沉淀戊分别为1.07 g和4.66 g,则可判断溶液中还有Cl-
D.该盐工业上可以用作净水剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在没有氧气存在时,铁与水几乎不反应,但高温下,铁能与水蒸气反应。请设计实验,证明还原铁粉与水蒸气能够发生反应。
(1)铁粉与水蒸气反应的化学方程式是: __________________________________________
(2)证明还原铁粉与水蒸气发生了反应的方法是_________________________________________
(3)某同学用如图所示装置进行实验,请帮助该同学完成设计,用下列简图画出未完成的实验装置示意图(铁架台可省略,导气管的形状可根据需要选择)
 __________
__________
(4)停止反应,待装置冷却后,取出反应过的还原铁粉混合物,加入过量的稀硫酸充分反应,过滤。若混和物中既有Fe3+又有Fe2+,则证明该结论的实验方法:_________________________________________
(5)经检验上述滤液中不含Fe3+,这不能说明还原铁粉与水蒸气反应所得产物中不含+3价的Fe元素。原因是(结合离子方程式说明)___________________________________________
(6)某同学利用上述滤液制取白色的Fe(OH)2沉淀,向滤液中加入NaOH溶液后,观察至生成的白色沉淀迅速变成灰绿色,最后变成红褐色。沉淀由白色→红褐色的化学方程式是:_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,4-环己二醇可通过下列路线合成(某些反应的反应物和反应条件未列出):

(1)写出反应④、⑦的化学方程式:
④__________________________________;
⑦__________________________________。
(2)上述七个反应中属于加成反应的有____________(填反应序号),A中所含有的官能团名称为____________。
(3)反应⑤中可能产生一定量的副产物,其可能的结构简式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2分解速率受多种因素影响。实验测得 70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是
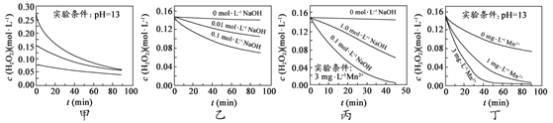
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.图丙表明,少量Mn 2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

(1)从氯化钾溶液中得到氯化钾固体,选择装置________(填代表装置图的字母,下同);分离饱和食盐水与沙子的混合物,选择装置________。
(2)从碘水中分离出I2,选择装置________,该分离方法的名称为________。
(3)装置A中①的名称是______,进水的方向是从____口(填“上”或“下”)进水。装置B在分液时为使液体顺利滴下,除打开漏斗下端的旋塞外,还应进行的具体操作是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com