
化学反应原理在科研和生产中有广泛应用。
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应:
TaS2(s)+2I2(g)TaI4(g)+S2(g) ΔH>0 (Ⅰ)
反应(Ⅰ)的平衡常数表达式K=________,若K=1,向某恒容容器中加入1 mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为________。
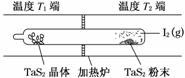
(2)如图所示,反应(Ⅰ)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净TaS2晶体,则温度T1________T2(填“>”、“<”或“=”)。上述反应体系中循环使用的物质是________。
(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为________,滴定反应的离子方程式为________________________________________________________________________。
(4)25℃时,H2SO3HSO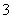 +H+的电离常数Ka=1×10-2 mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kb=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中
+H+的电离常数Ka=1×10-2 mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kb=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中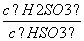 将________(填“增大”、“减小”或“不变”)。
将________(填“增大”、“减小”或“不变”)。
解析:本题考查化学反应速率、化学平衡及相关计算,意在考查考生灵活分析问题的能力。(1)在有气体参与的反应中,固体和液体的浓度不列入 化学平衡常数表达式中。设容器的容积是V L,
化学平衡常数表达式中。设容器的容积是V L,
TaS2(s)+2I2(g)TaI4(g)+S2(g)
起始浓度/ mol·L-1 1/V 0 0
转化浓度/ mol·L-1 2x x x
平衡浓度/ mol·L-1 (1/V-2x) x x
则K=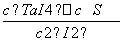 =
=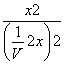 =1,x=
=1,x=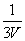 ,则I2(g)的平衡转化率是
,则I2(g)的平衡转化率是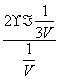 =66.7%。(2)根据平衡移动及物质的提纯,在温度T1端得到纯净的TaS2晶体,即温度T1端与T2端相比,T1端平衡向左移动,则T1<T2。生成物I2(g)遇冷可在管壁上凝结成纯净的I2(s),从而循环利用。(3)碘单质遇淀粉溶液变蓝色,当滴入最后一滴I2溶液时溶液由无色变为蓝色,且半分钟内不褪色,则说明达滴定终点。由I2~2e-~2I-,H2SO3~2e-~SO
=66.7%。(2)根据平衡移动及物质的提纯,在温度T1端得到纯净的TaS2晶体,即温度T1端与T2端相比,T1端平衡向左移动,则T1<T2。生成物I2(g)遇冷可在管壁上凝结成纯净的I2(s),从而循环利用。(3)碘单质遇淀粉溶液变蓝色,当滴入最后一滴I2溶液时溶液由无色变为蓝色,且半分钟内不褪色,则说明达滴定终点。由I2~2e-~2I-,H2SO3~2e-~SO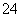 ,根据得失电子数相等则有I2~H2SO3,再结合原子守恒和电荷守恒配平。(4)H2SO3的电离常数表达式为Ka=
,根据得失电子数相等则有I2~H2SO3,再结合原子守恒和电荷守恒配平。(4)H2SO3的电离常数表达式为Ka=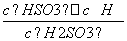 ,NaHSO3的水解反应的平衡常数Kh=
,NaHSO3的水解反应的平衡常数Kh=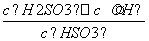 =
=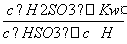 =
=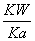 =
=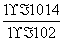 =1×10-12。加入I2后HSO
=1×10-12。加入I2后HSO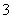 被氧化为H2SO4,c(H+)增大,c(OH-)减小,Kh不变,由Kh=
被氧化为H2SO4,c(H+)增大,c(OH-)减小,Kh不变,由Kh=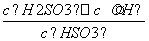 得
得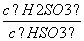 =
=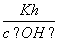 ,所以该比值增大。
,所以该比值增大。
答案:(1)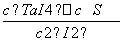 66.7% (2)< I2 (3)淀粉 I2+H2SO3+H2O===4H++2I-+SO
66.7% (2)< I2 (3)淀粉 I2+H2SO3+H2O===4H++2I-+SO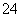
(4)1×10-12 增大


科目:高中化学 来源: 题型:
用NA表示阿伏伽德罗常数,下列说法正确的是( )
A.0.2 mol H2O2完全分解转移的电子数为0.4NA
B.含NA个Na+的Na2O溶于1L水中,Na+的物质的量浓度为1mol·L-1
C.在标准状况下,2.8g N2和2.24LCO所含电子数均为1.4NA
D. 2.24L SO2与O2混合气体中所含氧原子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述错误的是( )
A.某溶液中加入Ba( NO3)2溶液和稀盐酸(过量)析出白色沉淀,则溶液中一定含SO42一.
B.硫酸加入漂白粉中能生成氯气,可用排饱和食盐水法收集
C.NaOH溶液不能保存在带胶头滴管的试剂瓶中,因为NaOH与磨口处的SiO2反应生成Na2SiO3形成粘结
D.可用热的饱和碳酸钠溶液除去金属表面的植物油
查看答案和解析>>
科目:高中化学 来源: 题型:
某恒温密闭容器中,可逆反应A(s)B+C(g) ΔH=Q kJ/mol (Q>0)达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是( )
A.产物B的状态只能为固态或液态
B.平衡时,单位时间内n(A)消耗∶n(C)消耗=1∶1
C.保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动
D.若开始时向容器中加入1 mol B和1 mol C,达到平衡时放出热量Q
查看答案和解析>>
科目:高中化学 来源: 题型:
将a L NH3通入某恒压的密闭容器中,在一定条件下让其分解,达到平衡后气体体积增大到b L(气体体积在相同条件下测定)。下列说法中正确的是( )
A.平衡后氨气的分解率为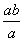 ×100%
×100%
B.平衡混合气体中H2的体积分数为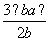 ×100%
×100%
C.反应前后气体的密度比为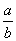
D.平衡后气体的平均摩尔质量为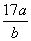 g
g
查看答案和解析>>
科目:高中化学 来源: 题型:
2013年初,雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为2NO(g)+2CO(g) 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。
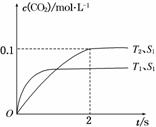
据此判断:
①该反应的ΔH________0(填“>”或“<”)
②在T2温度下,0~2 s内的平均反应速率v(N2)=______________________。
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
④若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是________(填代号)。
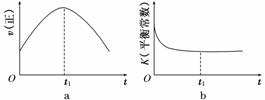
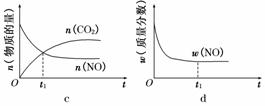
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产 生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
例如:CH4(g)+2NO2(g)===N2(g)+CO2(g)+2H2O(g) ΔH1=-867 kJ/mol
2NO2(g)N2O4(g) ΔH2=-56 .9 kJ/mol
.9 kJ/mol
写出CH4(g)催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(g)的热化学方程式:________________________________________________________________________。
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的
目的。如图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。催化剂b表面发生的电极反应式为__________________________。
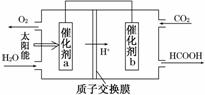
③常温下,0.1 mol·L-1的HCOONa溶液pH为10,则HCOOH的电离常数Ka=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,在等体积的①pH=0的H2SO4溶液、②0.05 mol/L的Ba(OH)2溶液、③pH=10的Na2S溶液、④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是( )
A.1∶10∶1010∶109 B.1∶5∶5×109∶5×108
C.1∶20∶1010∶109 D.1∶10∶104∶109
查看答案和解析>>
科目:高中化学 来源: 题型:
某课外活动小组进行Fe(OH)3胶体的制备实验并检验其性质。
(1)若将饱和FeCl3溶液分别滴入下列液体中,能形成胶体的是________。
A.冷水 B.沸水
C.NaOH浓溶液 D.NaCl浓溶液
(2)写出制备Fe(OH)3胶体的化学方程式:____________________________。
(3)怎样用最简捷的方法检验制得的物质是胶体?__________________________ _________________________________________________________________________。
(4)取少量制得的胶体加入试管中,加入(NH4)2SO4溶液,现象是____________________,这种现象称为胶体的______________________。
(5)氢氧化铁胶体稳定存在的主要原因是________。
A.胶体微粒直径小于1 nm B.胶体微粒带正电荷
C.胶体微粒做布朗运动 D.胶体微粒能透过滤纸
(6)Fe(OH)3胶体区别于FeCl3溶液的最本质特征是________。
A.Fe(OH)3胶体微粒的直径在1~100 nm之间
B.Fe(OH)3胶体具有丁达尔现象
C.Fe(OH)3胶体是均一的分散系
D.Fe(OH)3胶体的分散质能透过滤纸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com