
| A. | Na2CO3遇少量酸可转化为NaHCO3 | |
| B. | 在水中的溶解度Na2CO3比NaHCO3大 | |
| C. | 与同浓度的硫酸反应时,Na2CO3比NaHCO3剧烈 | |
| D. | NaHCO3比Na2CO3的碱性弱 |
分析 A.碳酸钠可以与少量酸反应生成碳酸氢钠;
B.碳酸的酸性大于碳酸氢根离子,则碳酸氢钠的水解程度小于碳酸钠;
C.碳酸氢钠与酸反应的剧烈沉淀大于碳酸钠;
D.碳酸钠的水解程度较大,则碱性碳酸钠大于碳酸氢钠.
解答 解:A.酸少量时,Na2CO3可与酸反应生成NaHCO3,如Na2CO3+HCl=NaCl+NaHCO3,故A正确;
B.在饱和Na2CO3溶液中通入过量二氧化碳气体可得到NaHCO3沉淀,说明Na2CO3比NaHCO3更易溶于水,故B正确;
C.与同浓度的硫酸反应时,反应离子方程式为:CO32-+2H+═CO2↑+H2O,HCO3-+H+═H2O+CO2↑,相同条件下NaHCO3比Na2CO3反应放出气体剧烈,故C错误;
D.碳酸的酸性反应碳酸氢根离子,则碳酸钠的水解程度大于碳酸氢钠,所以浓度相同时碳酸钠的碱性大于碳酸氢钠,故D正确;
故选C.
点评 本题考查Na2CO3和NaHCO3性质,题目难度中等,注意掌握Na2CO3和NaHCO3性质,明确二者的溶解度、热稳定性、与酸反应的剧烈程度大小,试题有利于培养学生的分析、理解能力及灵活应用所学知识的能力.


科目:高中化学 来源:2016-2017学年四川省高一上第一次月考化学卷(解析版) 题型:推断题
现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO3溶液。相应的实验过程可用下图表示:
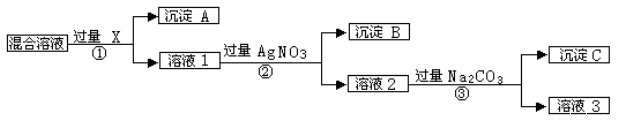
请回答下列问题:
(1)写出实验流程中下列物质的化学式: 试剂X_________,沉淀A________,沉淀B___________。
(2)上述实验流程中加入过量的Na2CO3的目的是________________________________,发生反应的方程式为 。
(3)简述从溶液3得到纯净的硝酸钠晶体的操作: 。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用50mL酸式滴定管准确量取23.20mL酸性KMnO4溶液,放入锥形瓶中待用 | |
| B. | 制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 | |
| C. | 使用pH试纸测定溶液pH时先润湿,则测得溶液的pH会发生变化 | |
| D. | 用惰性电极电解NaCl溶液一段时间后,再加入盐酸可使溶液与原溶液完全一样 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据物质的组成和性质特点,可以将物质分成混合物和纯净物,漂白粉、钢、水玻璃、液氨都为混合物 | |
| B. | 氨基酸、蛋白质、油脂、火棉中都含有C、H、O、N四种元素 | |
| C. | 李比希法可用于有机化合物组成中碳、氢元素质量分数的测定,同位素示踪法可用于研究化学反应历程机理 | |
| D. | 大豆蛋白、鸡蛋白分别溶于水所形成的分散系为胶体,在热、甲醛、饱和(NH4)2SO4溶液、X射线作用下,蛋白质的性质都会改变并发生变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
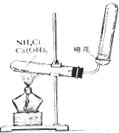 如图是实验室制取氨气的装置图,请回答下列问题:
如图是实验室制取氨气的装置图,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在纯水中加入硫酸或醋酸钠都会抑制水的电离 | |
| B. | 常温下,0.lmo1•Lˉ1氯化铵溶液加水稀释,溶液中的c(OHˉ)增大 | |
| C. | 1mL pH=2的醋酸溶液加水稀释到l0mL,pH变为3 | |
| D. | 常温下,0.1mol•L?1氨水加水稀释,溶液中的c(OHˉ)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
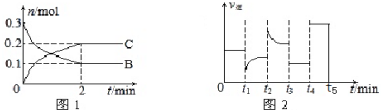
| A. | x=2.反应开始2min内,v(A)=0.05 mol•L-1•min-1 | |
| B. | 若tl时改变的条件是降温,平衡正向移动,则该反应为放热反应 | |
| C. | 若t2时改变的条件是增大c的浓度,则t2时正反应速率减小 | |
| D. | t3-t5时间段B的浓度一定未发生变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com