
| A. | 二氧化碳分子中存在共价键和分子间作用力 | |
| B. | 甲烷、氨和双氧水都是只由极性键结合而成的分子 | |
| C. | 同主族不同元素的最高价氧化物的水化物从上到下酸性递增 | |
| D. | 氟化氢的沸点高于氯化氢的沸点,水的沸点高于硫化氢的沸点 |
分析 A.二氧化碳分子间存在分子间作用力,分子内存在化学键;
B.结构对称,正负电荷的中心重合,则为非极性分子;极性分子中正负电荷的中心不重合,具有一定的极性;
C.元素的非金属性越强,其最高价氧化物的水化物的酸性越强;
D、同主族的氢化物,分子间存在氢键的沸点较高.
解答 解:A.二氧化碳分子中存在共价键、分子间存在分子间作用力,分子中不存在分子间作用力,故A错误;
B.CH4中含有极性键,空间结构为正四面体,正负电荷的中心重合,属于非极性分子,H2O2中含有极性键,空间结构不对称,属于极性分子;NH3中含有极性键,空间结构为三角锥形,正负电荷的中心不重合,属于极性分子,故B错误;
C.元素的非金属性越强,其最高价氧化物的水化物的酸性越强,同主族从上到下非金属性减弱,则最高价氧化物的水化物酸性减弱,故C错误;
D.氟化氢分子间存在氢键,氟化氢所以的沸点高于氯化氢的沸点,水分子间存在氢键,所以水的沸点高于硫化氢的沸点,故D正确;
故选D.
点评 本题考查化学键和分子间作用力,熟悉常见元素之间的成键是解答本题的关键,注意化学键、空间构型与分子的极性的有关.


 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验方法 | 实验现象 | 结论 |
| 在溶液中加入KSCN溶液 | 溶液变红色 | 固体物质中有FeCl3 |
| 在酸性KMnO4溶液中加入少量A | KMnO4溶液颜色无明显变化 | 固体物质中不含FeCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 装置图 | 所盛试剂 | 实验现象 | |
| 1 | 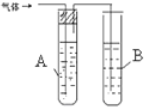 | A是 水 B是 酸性高锰酸钾溶液 | |
| 2 |  | C是 溴的四氯化碳溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图表示反应N2(g)+3H2(g)?2NH3(g);△H<0 在某一时间段反应速率与反应过程的曲线关系图,
如图表示反应N2(g)+3H2(g)?2NH3(g);△H<0 在某一时间段反应速率与反应过程的曲线关系图,查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| B. | 保持活塞位置不变,升高温度,达到新的平衡后,甲中B的体积分数增大,乙中B的体积分数减小 | |
| C. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 | |
| D. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 系统命名法命名为5-甲基-4-乙基-3-庚烯
系统命名法命名为5-甲基-4-乙基-3-庚烯 系统命名法命名为1,3二甲基苯
系统命名法命名为1,3二甲基苯 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8g18O2含有的中子数为5NA | |
| B. | 1molFeI2与足量Cl2氯气充分反应转移的电子数为2NA | |
| C. | 标准状况下22.4LNO与11.2LO2混合后的气体分子数约为NA | |
| D. | 7.8 g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com