
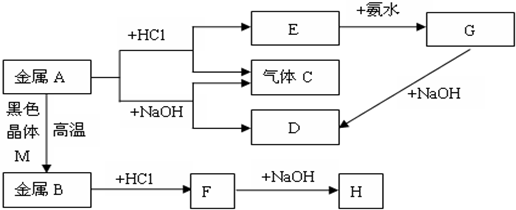
分析 金属A能与既能与盐酸反应生成气体C,又能与NaOH反应生成气体C,则A为Al,C为H2,E为AlCl3,D为NaAlO2,G为Al(OH)3,金属A与黑色晶体M在高温下反应得到金属B,B与盐酸反应生成F,F与氢氧化钠反应得到H为红褐色沉淀,则M为Fe3O4,B为Fe,F为FeCl2,H为Fe(OH)3,据此解答.
解答 解:金属A能与既能与盐酸反应生成气体C,又能与NaOH反应生成气体C,则A为Al,C为H2,E为AlCl3,D为NaAlO2,G为Al(OH)3,金属A与黑色晶体M在高温下反应得到金属B,B与盐酸反应生成F,F与氢氧化钠反应得到H为红褐色沉淀,则M为Fe3O4,B为Fe,F为FeCl2,H为Fe(OH)3.
(1)金属A为Al,物质D为NaAlO2,故答案为:Al;NaAlO2;
(2)E转化为G的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(3)G转化为D的离子方程式:Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O;
(4)A转化为D的化学方程式:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(5)G加热分解的化学方程式:2Al(OH)3+$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O,
故答案为:2Al(OH)3+$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O.
点评 本题考查无机物推断,“A能与酸、碱反应及与H为红褐色沉淀、M是黑色晶体”是推断的突破口,熟练掌握元素化合物性质,难度中等.


科目:高中化学 来源: 题型:选择题
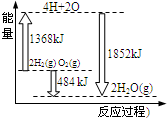
| A. | 该反应是吸热反应过程 | |
| B. | 由2molH2和1molO2变成4molH、2molO原子需要放出能量 | |
| C. | 2molH2(g)和1molO2(g)反应生成2molH2O(g),共放出484kJ能量 | |
| D. | 4molH、2molO生成2molH2O(g),共放出484kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol(燃烧热) | |
| B. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=-57.3kJ/mol(中和热) | |
| C. | S(s)+$\frac{3}{2}$O2(g)═SO3(g);△H=-269.8kJ/mol(反应热) | |
| D. | 2NO2=O2+2NO;△H=+116.2kJ/mol(反应热) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
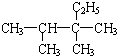 2,3,3-三甲基戊烷 (6)
2,3,3-三甲基戊烷 (6)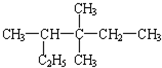 3,3,4-三甲基己烷.
3,3,4-三甲基己烷.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ② | D. | ⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体甲可与Z的某种氢化物反应生成强酸 | |
| B. | W元素的晶体单质是一种良好的半导体材料 | |
| C. | 化合物乙中一定只有共价键 | |
| D. | X分别与Y、Z、M、W形成的常见化合物中,稳定性最好的是XM |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 属于放热反应 | B. | 属于氧化还原反应 | ||
| C. | 由热能转化为化学能 | D. | 可用于工业生产熟石灰 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com